Polimerase Taq
Polimerase Taq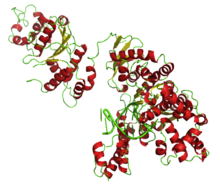 Estrutura de uma Taq polimerase ligada ao DNA em seu sítio ativo
Estrutura de uma Taq polimerase ligada ao DNA em seu sítio ativo
| EC No. | EC |
|---|---|
| Número CAS |
| IUBMB | Entrada IUBMB |
|---|---|
| IntEnz | Vista IntEnz |
| BRENDA | Entrada BRENDA |
| KEGG | Entrada KEGG |
| MetaCyc | Via metabólica |
| PRIAM | Perfil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| VAI | AmiGO / EGO |
 Polimerase Taq complexada com um inibidor de Fab ( PDB 1BGX )
Polimerase Taq complexada com um inibidor de Fab ( PDB 1BGX )
| Pfam | PF09281 |
|---|---|
| InterPro | IPR015361 |
| SCOP | 1qtm |
| SUPERFAMÍLIA | 1qtm |
A Taq polimerase (também conhecida como " Taq pol" ou simplesmente " Taq ") é uma variedade de DNA polimerases termoestáveis em homenagem a Thermus aquaticus , uma bactéria termofílica da qual esta enzima foi isolada pela primeira vez em 1969.
Sua meia-vida enzimática a 95 ° C é de 40 minutos.
É desprovido de atividade de exonuclease , o que torna impossível corrigir erros durante a cópia.
Alguns resultados de PCR insatisfatórios ( falsos negativos ) em certas amostras de DNA (especialmente de urina ou expectoração ) podem ser devidos a um inibidor desta enzima presente na urina, mas não no sangue .
Usos
Esta enzima é usada em bioquímica para fazer reações de PCR .
Uma vez que comete um erro para cada milhão de pares de bases, o amplicon (o produto da reação) será usado para análise.
Se alguém quiser "clonar" o produto da reação, então usaremos uma DNA polimerase Pwo (en) ou uma DNA polimerase Pfu , que cometem menos erros.
Clonagem A-T
A polimerase Taq adiciona um " A " no final do fragmento gerado.
Isto torna possível realizar uma clonagem de extremidade coesiva com um vetor com um " T ".
"Hot Start"
“Hot Start” designa uma enzima com um inibidor ( proteína chaperona ou molécula química).
Este inibidor deve ser removido por aquecimento da enzima a 95 ° C por 10 ou 15 minutos. Esta operação é chamada de " ativação da enzima ".
Veja também
Artigos relacionados
links externos
Notas e referências
- (em) Soo Hyun Eom, Jimin Wang e Thomas A. Steitz , " Structure of Taq polimerase with DNA polimerase active at the website " , Nature , vol. 382, n o 6588, 18 de julho de 1996, p. 278-281 ( PMID 8717047 , DOI 10.1038 / 382278a0 , leia online )
- (in) R. Murali, DJ Sharkey, JL Daiss e HM Krishna Murthy , " Crystal structure of Taq DNA polimerase in complex with an inibitory Fab: O Fab é dirigido contra o ano intermediário na dinâmica da hélice-bobina da enzima " , Proceedings of the National Academy of Sciences dos Estados Unidos da América , vol. 95, n o 21, Outubro de 1998, p. 12562-12567 ( PMID 9770525 , PMCID 22870 , DOI 10.1073 / pnas.95.21.12562 , JSTOR 46098 , Bibcode 1998PNAS ... 9512562M , ler online )
- (em) A. Chien, DB Edgar e JM Trela , " Deoxyribonucleic acid polimerase from the extreme thermophilic Thermus aquaticus " , Journal of Bacteriology , Vol. 127, n o 3, Setembro de 1976, p. 1550-1557 ( PMID 8432 , PMCID 232952 , leia online )
- Dieter Perl, Uwe Mueller, Udo Heinemann e Franz X. Schmid, 2000, “ Dois resíduos de aminoácidos expostos conferem termoestabilidade em uma proteína de choque frio ”, Nature estrutural biology , volume 7, número 5, páginas 380 a 383.
- Iniciação à biologia molecular; Módulo: amplificação de genes , Fundação Mérieux