Etano
| Etano | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
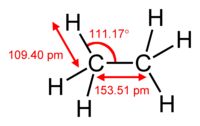
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molécula de etano | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identificação | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nome IUPAC | etano | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sinônimos |
dimetil |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o ECHA | 100.000.741 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o EC | 200-814-8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | 6324 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SORRISOS |
CC , |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI |
InChI: InChI = 1S / C2H6 / c1-2 / h1-2H3 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aparência | gás comprimido liquefeito, incolor, inodoro em seu estado puro. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades quimicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fórmula bruta |
C 2 H 6 [Iseros] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massa molar | 30,069 ± 0,002 g / mol C 79,89%, H 20,11%, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades físicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fusão T ° | −183,3 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° fervendo | -88,6 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solubilidade |
60,2 mg · l -1 ( água , 25 ° C ) 460 ml · l -1 ( etanol , 4 ° C ) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Parâmetro de solubilidade δ | 12,3 MPa 1/2 ( 25 ° C ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massa volumica |
1,3551 kg · m -3 ( 0 ° C , 1 013 mbar , gás) 0,5441 kg · l -1 ( -88,6 ° C , 1 013 mbar , líquido) equação:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Temperatura de autoignição | 515 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de inflamação | -135 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Limites explosivos no ar |
2,4 - 14,3 % em volume 31 - 182 g · m -3 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pressão de vapor de saturação |
37,8 bar a 20 ° C 46,9 bar a 30 ° C equação:
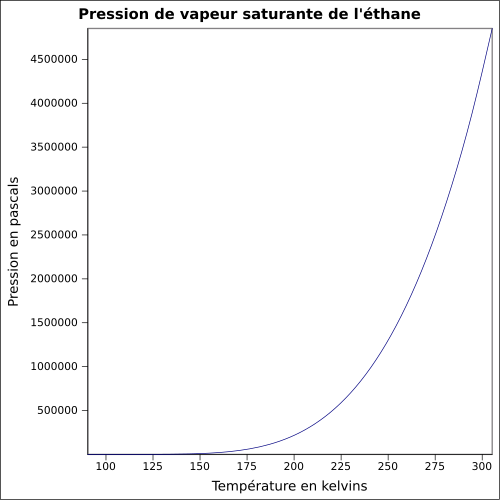
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Viscosidade dinamica | 63,4 mPo a -78,5 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto crítico |
32,15 ° C 49 bar 0,147 l · mol -1 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto Triplo |
-182,15 ° C 0,011 bar |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidade do som |
1326 m · s -1 (líquido, -88,6 ° C ) 312 m · s -1 (gás, 27 ° C , 1 atm ) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termoquímica | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| S 0 líquido, 1 bar | 126,7 J · mol -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ f H 0 gás | -84,0 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ fus H ° | 0,583 kJ · mol -1 a -182,81 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ vap H ° |
9,76 kJ · mol -1 a 25 ° C 14,703 kJ · mol -1 a -89,05 ° C |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| C p |
52,49 J · mol -1 · K -1 ( 25 ° C , gás) 68,68 J · mol -1 · K -1 ( -173,15 ° C , líquido) equação:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PCS | 1 560,7 kJ · mol -1 ( 25 ° C , gás) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PCI | 1 437,11 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades eletrônicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 energia de re ionização | 11,56 ± 0,02 eV (gás) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cristalografia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Classe de cristal ou grupo espacial | P21 / n | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Parâmetros de malha |
a = 4,226 Å b = 5,623 Å |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volume | 190,10 Å 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Precauções | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  Perigo H220, H220 : Gás extremamente inflamável |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| WHMIS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  A, B1, A : Temperatura crítica do gás comprimido = 32,27 ° C B1 : Limite inferior de inflamabilidade do gás inflamável = 3,0% Divulgação a 1,0% de acordo com os critérios de classificação |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NFPA 704 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4 1 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Transporte | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
23 : gás inflamável Número ONU : 1035 : Classe ETHANE : 2.1 Rótulo: 2.1 : Gases inflamáveis (corresponde aos grupos designados por um F maiúsculo); Embalagem: - 
223 : gás liquefeito refrigerado, inflamável Número ONU : 1961 : LÍQUIDO REFRIGERADO ETHANE Classe: 2.1 Etiqueta: 2.1 : Gases inflamáveis (corresponde aos grupos designados por um F maiúsculo); Embalagem: -  |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ecotoxicologia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LogP | 1,81 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unidades de SI e STP, salvo indicação em contrário. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
O etano é um hidrocarboneto da família dos alcanos de fórmula empírica C 2 H 6. É um gás combustível , incolor e inodoro, que pode ser encontrado no gás natural e também nos gases do petróleo .
usar
Etano é o reagente básico para a síntese de etileno via steam cracking , monocloro- , 1,1-dicloro- e 1,1,1-tricloroetano por cloração . Ao combinar a cloração com a oxicloração , o cloreto de vinila pode ser sintetizado e a reação do etano com o ácido nítrico na fase gasosa permite a formação de nitrometano e nitroetano .
O etano é um constituinte do gás liquefeito de petróleo, um combustível usado como substituto do gás natural para aplicações específicas.
Propriedades físico-químicas
O etano é decomposto a partir de uma temperatura de 500 ° C . Sua solubilidade em água e em álcool é melhor que a do metano , pois, a 20 ° C , é 4,7 cm 3 por 100 cm 3 de água e 150 cm 3 por 100 cm 3 de álcool .
Produção e síntese
O etano é derivado principalmente da purificação do gás natural ou extraído do gás liquefeito de petróleo , uma fração do petróleo.
Transporte
Atualmente é transportado liquefeito, mas poderá um dia também estar na forma de hidrato de etano ( clatrato ).
Ecologia
O etano é um poluente atmosférico classificado entre os VOCs ( Composto Orgânico Volátil ).
É um dos precursores da poluição fotoquímica , que conduz em particular à poluição pelo ozônio troposférico .
É também considerado um traçador interessante porque está associado a emissões geológicas de metano (gás de xisto, gás natural, fumos de petróleo leve), mas não com emissões de metano biogênico (razão pela qual tem sido objeto de monitoramento nos últimos anos. espaço) e modelagem).
Emissões naturais e antrópicas
Na Terra , medimos liberações da ordem de quinze megatons desse gás na atmosfera por ano:
- dois a quatro megatons são liberados por vulcões de lama , fontes geotérmicas , bacias de petróleo e vazamentos de gás no fundo do oceano;
- cerca de dez megatons vêm de incêndios florestais , atividade biológica nos oceanos, vida selvagem e humanos.
- uma quantidade não medida até o momento vem de vazamentos de furos de sondagem, gasodutos e instalações de petróleo e gás e, em particular, gás de xisto com base em fraturamento hidráulico .
Etano e gás de xisto
Um estudo publicado em maio de 2015 na revista Atmospheric Environment mostra que o etano é um bom marcador de vazamentos de gás ligados à exploração do gás de xisto. Esses vazamentos podem ser detectados centenas de quilômetros a favor do vento nas áreas de extração, inclusive nos Estados Unidos, em estados que proíbem ou controlam estritamente o fracking .
Este estudo acompanhou anomalias detectadas no conteúdo do ar de etano nos Estados Unidos a partir de 2010, onde foi detectado em quantidades significativas em estados onde não deveria ser emitido: '' houve uma diminuição geral nas emissões de COV não metano e uma melhoria na qualidade do ar desde 1996, o nível de etano no ar , de 2010 a 2013, aumentou drasticamente de 7 a 15% do total de carbono orgânico não metano no ar, um aumento de “cerca de 30 por cento de 2010 a 2013 ” . Naquela época, as emissões de metano não eram suficientemente monitoradas no país para serem associadas a essas anomalias no nível de etano no ar. Embora nada em Maryland pudesse explicar o aumento no nível de etano, foi rapidamente descoberto que os valores horários medidos por estações de monitoramento fotoquímico em Baltimore e Washington DC estavam fortemente correlacionados com a direção do vento e a evolução das atividades de fraturamento na Bacia de Marcellus ( onde o gás de xisto foi explorado em grande escala por alguns anos), a uma grande distância a montante (em relação ao vento) do ponto de medição. Modelos meteorológicos (baseados na rosa dos ventos e na velocidade do vento) confirmaram que Maryland foi exposto às caudas da pluma de emissões distantes da Pensilvânia , Virgínia Ocidental e Ohio . Em Maryland, os ventos predominantes originam-se da Bacia Marcellus 2/3 do tempo.
Os autores do estudo conseguiram excluir das causas todas as fontes capazes de explicar o aparecimento desses picos de etano no ar (incluindo veículos, vazamentos de gasodutos ou armazenamento de gás natural em Garrett County , Md., Localizado a 155 milhas do área de estudo). Eles descobriram ainda que a mesma análise não revelou esses picos de etano para Atlanta , Geórgia. Que está localizado em uma área não afetada pelo desenvolvimento generalizado de gás natural e sem novas operações de petróleo e gás. Este estudo confirma o trabalho anterior mostrando que subestimamos a poluição do metano induzida pela exploração do gás de xisto, e mostra que essa poluição pode ter efeitos distantes (sabendo que o etano é considerado aqui como um traçador para outros mais nocivos ( mercúrio ) ou mais gases reativos de poços, mas também de perfuração, completação, reativação e instalações e obras de segurança em fim de vida ( óxidos de nitrogênio , poluição por partículas, dióxido de enxofre e vapores de hidrocarbonetos também fontes de poluição do ar).
Para R. Subramanian (pesquisador da Carnegie Mellon , especializado no estudo de partículas atmosféricas, cujo trabalho tem mostrado que o etano é um excelente marcador de emissões de metano na exploração e transporte de gás natural), este estudo mostra a contribuição potencial do gás de xisto extração na Pensilvânia para a qualidade do ar em estados de sotavento, e a necessidade de considerar o transporte interestadual dessa poluição na formulação de regulamentos ambientais relativos à poluição por partículas e controle de ozônio no nível do solo .
Para Ehrman, esses resultados também são fortes indícios de que não podemos mais falar em poluição local, mas que existe um “problema regional” . Ele acrescenta que os autores queriam com esta publicação “trazer este assunto à atenção do público, e defender o monitoramento de longo prazo do metano, e promover a cooperação regional no monitoramento e redução das emissões da produção de gás natural” .
Biodegradabilidade na natureza
Micróbios metanotróficos são conhecidos há várias décadas , particularmente encontrados em certos sedimentos marinhos. Embora a reação bioquímica necessária seja complexa e termodinamicamente improvável, os pesquisadores acreditavam, portanto, que também pode haver micróbios capazes de consumir etano (emitido em cerca de 10% das plumas de gás natural encontradas localmente no mar profundo). superfície compõe cerca de 5% do metano atmosférico).
Um primeiro microrganismo capaz de consumir etano em condição anaeróbia foi descoberto no fundo do mar (publicação 2019): a archaea Argoarcheum ethanivorans ; oxida o etano graças a uma simbiose com outro microrganismo que o abastece de oxigênio, em uma ação mutualista ( sintrofia ), reduzindo o sulfato a sulfeto .
Notas e referências
- ETHANE , segurança folha (s) de Programa Internacional sobre a Segurança das Substâncias Químicas , consultado sobre 09 de maio de 2009
- massa molecular calculada de " pesos atômicos dos elementos 2007 " em www.chem.qmul.ac.uk .
- Entrada "Etano" na base de dados química GESTIS do IFA (órgão alemão responsável pela segurança e saúde ocupacional) ( alemão , inglês ), acessado em 19 de abril de 2009 (JavaScript necessário)
- “ ETHANE ” , sobre Substâncias Perigosas Banco de Dados (acessados 29 de novembro de 2009 )
- (em) James E. Mark, Physical Properties of Polymer Handbook , Springer,2007, 2 nd ed. , 1076 p. ( ISBN 978-0-387-69002-5 e 0-387-69002-6 , leia online ) , p. 294
- (en) Robert H. Perry e Donald W. Green , Perry's Chemical Engineers 'Handbook , EUA, McGraw-Hill,1997, 7 th ed. , 2400 p. ( ISBN 0-07-049841-5 ) , p. 2-50
- (en) "Etano" , no NIST / WebBook , acedido fevereiro 2010 11
- (em) William M. Haynes , CRC Handbook of Chemistry and Physics , Boca Raton, CRC Press / Taylor and Francis,1 st julho 2010, 91 th ed. , 2610 p. ( ISBN 9781439820773 , apresentação online ) , p. 14-40
- (em) Carl L. Yaws, Handbook of Thermodynamic Diagrams: Organic Compounds C8 a C28 , vol. 1, Huston, Texas, Gulf Pub. Co.,1996, 396 p. ( ISBN 0-88415-857-8 )
- (em) David R. Lide , CRC Handbook of Chemistry and Physics , Boca Raton, CRC Press,18 de junho de 2002, 83 th ed. , 2664 p. ( ISBN 0849304830 , apresentação online ) , p. 5-89
- (em) David R. Lide, Handbook of Chemistry and Physics , Boca Raton, CRC,2008, 89 th ed. , 2736 p. ( ISBN 978-1-4200-6679-1 ) , p. 10-205
- “ etano ” , pelo www.reciprocalnet.org (acessada 12 dezembro de 2009 )
- Número de índice na tabela 3.1 do apêndice VI do regulamento CE nº 1272/2008 (16 de dezembro de 2008)
- " Ethane " no banco de dados de produtos químicos Reptox da CSST (organização de Quebec responsável pela segurança e saúde ocupacional), acessado em 25 de abril de 2009
- "etano" , em ESIS , acessado em 15 de fevereiro de 2009
- Karl Griesbaum, Arno Behr, Dieter Biedenkapp, Heinz-Werner Voges, Dorothea Garbe, Christian Paetz, Gerd Collin, Dieter Mayer, Hartmut Höke, Ullmann's Encyclopedia of Industrial Chemistry , Hydrocarbonbons , Wiley-VCH Verlag GmbH & Co,2000
- R. Kumar, P. Linga, I. Moudrakovski, JA Ripmeester, e P. Englezos, Estrutura e cinética de hidratos de gás de misturas de metano / etano / propano relevantes para o projeto de instalações de transporte e armazenamento de hidrato de gás natural. AlChE J. 2008; 54 (8), 2132–2144.
- Olhando para o espaço para quantificar vazamentos de gás natural na Terra ; Phys.org 2015, Science X network, publicado em 24 de março de 2015, acessado em 2 de maio de 2015
- Science & Vie, Sabemos o que a Terra desgaseifica com hidrocarbonetos , nº 1098, março de 2009, p. 34
- Vinciguerra, t & al. (2015) " Impactos regionais da qualidade do ar de fraturamento hidráulico e atividade de gás natural de xisto: Evidência de observações de VOC ambientais ," Atmospheric Environment, Volume 110, junho de 2015, Pages 144-150, ISSN 1352-2310, dx.doi.org/10.1016 /j.atmosenv.2015.03.056 ( resumo )
- Notícias ( 1 ° de maio de 2015) Emissões de poços de gás natural podem viajar muito a favor do vento , Phys.org, Science X Network
- Timothy Vinciguerra, Simon Yao, Joseph Dadzie, Alexa Chittams, Thomas Deskins, Sheryl Ehrman, Russel R. Dickerson (2015), Impactos regionais da qualidade do ar de fraturamento hidráulico e atividade de gás natural de xisto: Evidência de observações de VOC ambientais; Atmospheric Environment Volume 110, junho de 2015, páginas 144-150
- (2019) Micróbio evasivo que consome etano encontrado no fundo do mar; Um microorganismo que consome etano na ausência de oxigênio ambiental foi descoberto. Nas profundezas do mar, esse micróbio, que oxida o etano, faz parceria com outro que reduz o sulfato a sulfeto , publicado em 27 de março pela revista Nature
- Chen SC et al. , Oxidação anaeróbica de etano por arquéias de uma infiltração de hidrocarboneto marinho. , 2019 DOI : 10.1038 / s41586-019-1063-0






