Cloro
| Cloro | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cloro em uma ampola. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identificação | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nome IUPAC | cloro | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o ECHA | 100.029.053 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o EC | 231-959-5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o E | E925 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aparência | gás amarelo-esverdeado, odor pungente | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades quimicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fórmula bruta |
Cl 2 [isômeros] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massa molar | 70,906 ± 0,004 g / mol Cl 100%, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades físicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fusão T ° | −101 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° fervendo | -34,6 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solubilidade |
14,6 g · l -1 em água a 0 ° C , 7,3 g · l -1 a 20 ° C , 5,7 g · l -1 a 30 ° C |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
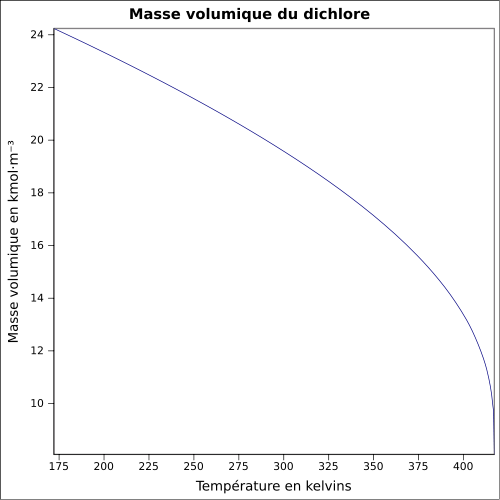
| Massa volumica | 2,48 (densidade relativa de ar) em 20 ° C , 6,864 atm : 1,4085 g · cm -3 (liq.) A -35 ° C , 0,9949 atm : 1,5649 g · cm - 3 (. Liq) equação:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pressão de vapor de saturação |
6,776 bar a 20 ° C 8,8 bar a 30 ° C 14,3 bar a 50 ° C equação:
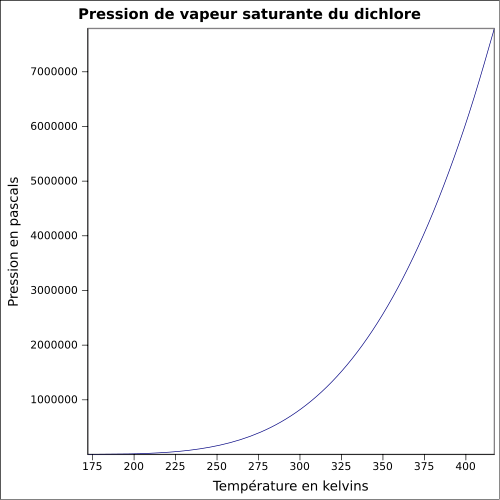
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto crítico |
143,81 ° C 79,914 bar 0,57688 kg · s -1 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto Triplo |
-100,98 ° C 0,01387 bar |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidade do som | 206 m · s -1 ( 0 ° C , 1 atm ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termoquímica | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ vap H ° |
20,41 kJ · mol -1 ( 1 atm , -34,04 ° C ); 17,65 kJ · mol -1 ( 1 atm , 25 ° C ) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| C p |
equação:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades eletrônicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 energia de re ionização | 11,480 ± 0,005 eV (gás) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cristalografia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Símbolo Pearson | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Classe de cristal ou grupo espacial | CMCA ( n o 64) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Strukturbericht | A14 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estrutura típica | I 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Precauções | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
    Perigo H270, H315, H319, H331, H335, H400, H270 : Pode causar ou agravar incêndios; oxidante H315 : Provoca irritação cutânea H319 : Provoca irritação ocular grave H331 : Tóxico por inalação H335 : Pode causar irritação respiratória H400 : Muito tóxico para organismos aquáticos |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| WHMIS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
   A, D1A, E, A : Pressão absoluta de vapor de gás comprimido a 50 ° C = 750 kPa D1A : Material muito tóxico com efeitos imediatos graves Transporte de mercadorias perigosas: classe 2.3 E : Material corrosivo Transporte de mercadorias perigosas: classe 8 Divulgação a 1,0% de acordo com a divulgação do ingrediente lista Comentários: conforme apresentado na interpretação de uma política de saúde no Canadá, o símbolo de perigo D1 (caveira) não precisa aparecer na etiqueta do fornecedor. No entanto, todos os riscos à saúde e à segurança apresentados por este produto devem ser divulgados no rótulo e na FISPQ. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NFPA 704 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 0 4 0 BOI | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Transporte | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
265 : gás venenoso e oxidante (promove incêndio) Número UN : 1017 : CLORO Classe: 2.3 Código de classificação: 2TOC : Gás liquefeito, tóxico, oxidante, corrosivo. Rótulos: 2.3 : Gases tóxicos (corresponde aos grupos designados por um T maiúsculo, ou seja, T, TF, TC, TO, TFC e TOC). 5.1 : Substâncias oxidantes 8 : Substâncias corrosivas    |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Inalação | odor sufocante | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ecotoxicologia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CL 50 | 1 hora: rato 293 ppm camundongo 137 ppm |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Limiar de odor | baixo: 0,02 ppm alto: 3,4 ppm |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unidades de SI e STP, salvo indicação em contrário. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
O cloro ( Cl 2 ) é um gás verde-amarelo em condições padrão de temperatura e pressão ( cloros significa "verde" em grego ). É 2,5 vezes mais denso que o ar . Tem um odor sufocante muito desagradável e é extremamente tóxico, pois se recombina com a umidade nas membranas mucosas e nos pulmões para formar ácidos que atacam os tecidos.
O cloro foi descoberto por Carl Wilhelm Scheele em 1774 . Foi usado na Primeira Guerra Mundial como gás de combate , bertholite .
O cloro é solúvel em água formando cloro , mas não é solúvel em água salgada.
A molécula de cloro é formada por dois átomos de cloro .
Produção
O cloro pode ser produzido facilmente eletrolisando uma solução de cloreto de sódio ( processo de cloralcal ):
2Na + + 2Cl - + 2H 2 O→ 2 NaOH + Cl 2 + H 2Scheele o sintetizou pela reação de dióxido de manganês (MnO 2 ) com ácido clorídrico (HCl).
Também pode ser feito em pequenas quantidades pela reação de ácido clorídrico com permanganato de potássio .
Além disso, quando um ácido é despejado na água sanitária , uma liberação de cloro é observada (mas na presença de uréia, presente na urina, ela libera tricloramina (NCl 3 ); um gás muito irritante). O grau clorométrico de uma solução de alvejante é o volume de cloro liberado por um litro dessa solução (excesso de ácido).
Cl - > + ClO - + 2H + → Cl 2 + H 2 Ousar
O cloro é usado como matéria-prima para produzir ácido clorídrico pela reação entre o cloro e o di - hidrogênio .
Cl 2 + H 2 → 2HClTambém é usado para produzir cloreto de polivinila (PVC).
É utilizado na fabricação de produtos com ligação carbono-cloro, como o refrigerante R12 diclorodifluorometano .
Também serve para desinfetar a água potável no lugar da água sanitária .
Foi utilizado como gás de combate (porque irrita o trato respiratório superior e é tóxico) durante a Primeira Guerra Mundial, onde deixou cinco mil mortos e quinze mil sobreviventes, e deixou as vítimas com consequências para toda a vida na maioria dos casos. Mais graves .
Propriedades
O cloro tem a propriedade de descolorir a solução do índigo e de várias outras substâncias orgânicas. A cor de muitos corantes orgânicos vem das diferenças entre os vários níveis de energia de suas ligações conjugadas . No entanto, o cloro oxida as ligações duplas carbono-carbono que constituem os sistemas de ligações conjugadas.
Referências
- CLORO , ficha (s) de segurança do Programa Internacional de Segurança de Substâncias Químicas , consultado em 9 de maio de 2009
- massa molecular calculada de " pesos atômicos dos elementos 2007 " em www.chem.qmul.ac.uk .
- (en) Robert H. Perry e Donald W. Green , Perry's Chemical Engineers 'Handbook , Estados Unidos, McGraw-Hill,1997, 7 th ed. , 2400 p. ( ISBN 0-07-049841-5 ) , p. 2-50
- (em) W. M Haynes, Handbook of Chemistry and Physics , CRC, 2010-2011 91 th ed. , 2610 p. ( ISBN 978-1-4398-2077-3 ) , p. 14-40
- (em) David R. Lide, CRC Handbook of Chemistry and Physics , CRC Press,2009, 90 th ed. , 2804 p. , Capa dura ( ISBN 978-1-4200-9084-0 )
- (em) David R. Lide, Handbook of Chemistry and Physics , Boca Raton, CRC,2008, 89 th ed. , 2736 p. ( ISBN 978-1-4200-6679-1 ) , p. 10-205
- " The Molecular Iodine (I2) Crystal Structure (A14) " , em http://cst-www.nrl.navy.mil/ (acessado em 17 de dezembro de 2009 )
- índice Número na Tabela 3.1 do anexo VI do Regulamento CE n o 1272/2008 (16 de dezembro 2008)
- " Cloro " no banco de dados de produtos químicos Reptox da CSST (Organização de Quebec responsável pela segurança e saúde ocupacional), acessado em 25 de abril de 2009
- " O cloro, " em hazmap.nlm.nih.gov (acessada 14 novembro, 2009 )
- " Arquivo: Alvejante - Solução aquosa de hipoclorito de sódio " [PDF] , Câmara Nacional de Alvejante, maio de 2010, p. 8 , § 7: Segurança para humanos, em eaudejavel.fr
- " Exposição individual e em grupo a vapores de cloro ", Belgian Poison Centre
- " Gás: 22 de abril de 1915 em Ypres (Bélgica) " , sobre a Grande Guerra
- Química, terminal S obrigatório, programa de 2002 , Nathan, col. "Sírius",2008, 351 p. ( ISBN 978-2-09-172496-6 ) , p. 248