Vanilina
| Vanilina | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
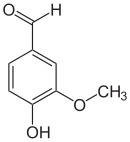  representações da molécula de vanilina |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identificação | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nome IUPAC | 4-hidroxil-3- metoxibenzaldeído | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sinônimos |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o ECHA | 100.004.060 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o EC | 204-465-2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o RTECS | YW5775000 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | 1183 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| FEMA | 3107 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SORRISOS |
O = CC1 = CC (OC) = C (O) C = C1 , |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI |
InChI: InChI = 1S / C8H8O3 / c1-11-8-4-6 (5-9) 2-3-7 (8) 10 / h2-5,8H, 1H3 InChIKey: MWOOGOJBHIARFG-UHFFFAOYSA-N |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aparência |
sólido branco (geralmente em agulhas) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades quimicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fórmula bruta |
C 8 H 8 O 3 [Isômeros] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massa molar | 152,1473 ± 0,0079 g / mol C 63,15%, H 5,3%, O 31,55%, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| pKa | 7,40 ( 25 ° C ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades físicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fusão T ° | 353-354 K ( 81,5 ° C ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° fervendo | 558 K ( 285 ° C ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solubilidade |
10 g · l -1 em água ( 25 ° C ) Livremente moído. em clorofórmio , éter, CS 2 , ácido acético glacial , piridina . |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massa volumica | 1,056 g · cm -3 (sólido) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de inflamação | 147 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termoquímica | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| C p |
equação:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Precauções | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Aviso H319, P305 + P351 + P338, H319 : Provoca irritação ocular grave P305 + P351 + P338 : Se entrar em contacto com os olhos: enxaguar cuidadosamente com água durante vários minutos. Remova as lentes de contato se a vítima as estiver usando e elas podem ser removidas facilmente. Continue a enxaguar. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Diretiva 67/548 / EEC | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Frases R : R22 : Nocivo por ingestão. Frases S : S24 / 25 : Evitar o contato com a pele e os olhos. Frases R : 22, Frases S : 24/25, |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ecotoxicologia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| DL 50 |
1580 mg · kg -1 (rato, oral ) 3925 mg · kg -1 (camundongo, oral ). |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Considerações Terapêuticas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aula terapêutica | Antioxidantes | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Compostos relacionados | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isômero (s) | Salicilato de metila , ácido mandélico | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Outros compostos | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unidades de SI e STP, salvo indicação em contrário. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
A vanilina é um aldeído aromático natural que se desenvolve nas vagens da baunilha na preparação da mesma como especiaria .
É usado para fazer sabores naturais.
Origem
A vanilina é o mais importante e característico dos muitos componentes do aroma natural da baunilha . Representa 0,75% a 2% da massa da vagem. Uma cápsula pesando cerca de três gramas contém, portanto, apenas 22 a 60 mg .
Foi extraído pela primeira vez em seu estado puro pelo químico Théodore Nicolas Gobley por maceração de baunilha em álcool a 85 ° , seguida de extração com éter . A substância castanha muito perfumada que obtém após a evaporação é levada a ferver em água e depois filtrada a quente. A vanilina é finalmente isolada após várias recristalizações sucessivas na forma de longas agulhas incolores.
A vanilina foi sintetizada pela primeira vez em 1874 por Wilhelm Haarmann e Ferdinand Tiemann , a partir da coniferina, um derivado do isoeugenol encontrado na casca do pinheiro. Karl Reimer propôs dois anos depois, em 1876, uma nova rota sintética a partir do guaiacol .
Propriedades físicas e químicas
A molécula é um aldeído aromático , daí seus outros nomes de vanilaldeído ou aldeído vanílico. Em solução, na presença de ferro e outro composto alcalino , o aldeído desenvolve uma coloração vermelha e perde seu poder odorífero.
A baunilha tem um cheiro semelhante ao da baunilha com um sabor adocicado. Sua intensidade aromática é, no entanto, 2 a 4 vezes menos poderosa do que a etil vanilina .
Produção e síntese
A vanilina pode ser feita de forma barata por vários processos, enquanto a baunilha é muito cara para produzir e preparar. Assim, a produção industrial de vanilina e seu uso em alimentos e perfumes tornaram-se muito mais importantes do que a produção e o uso de baunilha natural.
A título indicativo, 1 kg de vagens inteiras de baunilha vale cerca de 500 euros, enquanto 1 kg de vagens de baunilha em pó custa cerca de 40 euros e um quilo de sabor líquido artificial de baunilha custa cerca de 10 euros.
Síntese de guaiacol
Em 1876, Karl Reimer preparou vanilina a partir de guaiacol . Após a dissolução do guaiacol em uma solução de hidróxido de potássio , o conjunto reage com clorofórmio . Esta reação dá origem à formação de vanilina, bem como um isômero, metoxialdeído salicílico. Os dois compostos assim formados são separados por destilação a vapor sob pressão de 2 atmosferas .
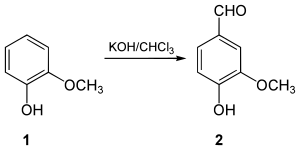
Síntese de 4-hidroxibenzaldeído
A vanilina pode ser sintetizada a partir de 4-hidroxibenzaldeído . Esta preparação é realizada em duas etapas envolvendo uma substituição eletrofílica aromática para incorporar um átomo de bromo no anel aromático seguida por uma metoxilação organometálica com um catalisador de cobre.
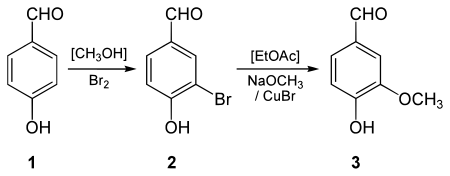
Síntese de eugenol
O eugenol é extraído do cravo .
O eugenol (1) é convertido em isoeugenol (2), depois em acetato de isoeugenol, depois em acetato de vanilina e depois em vanilina .

Síntese de lignina
Usamos a lignina recuperada da celulose da indústria de águas residuais . Esta rota sintética oxida os ácidos lignossulfônicos usando oxidação úmida .
Síntese de curcumina
A curcumina é extraída da cúrcuma .
Biogênese a partir de resíduos de açúcar da beterraba ou da indústria do milho
Um processo de decomposição do ácido ferúlico do milho industrial ou dos resíduos da beterraba (por um fungo) resulta em um aroma rico em vanilina. Como o processo é bioquímico, o sabor pode ser considerado um sabor natural e rotulado como tal na composição de preparações alimentícias.
Pesquisa e desenvolvimento
Um novo método apresentado em 2017 por acadêmicos indianos que o apresenta como sendo mais ecologicamente correto, usa - à pressão atmosférica - um catalisador composto de elementos não raros ( sílica e cobre ) para isolar efetivamente a vanilina, separando-a de outros compostos em água fervente .
Este catalisador pode ser reciclado quatro vezes sem perder sua eficiência, enquanto os calisers tradicionais tiveram que ser substituídos após o uso.
Além disso, este método não produz mais água residual com um pH extremamente alto (o que exigia neutralização com ácido clorídrico antes da descarga no meio ambiente.
Diferenças de baunilha
A vanilina extraída da fava de baunilha é exatamente a mesma que é feita industrialmente.
A diferença de qualidade vem da complexidade e riqueza do aroma natural da baunilha que contém muitos outros componentes, enquanto a vanilina obtida por síntese é quimicamente pura. Os processos de biogênese, por outro lado, resultam na formação de um aroma complexo, e não em um produto quimicamente puro .
Produção mundial
A vanilina é o sabor mais fabricado no mundo, muito à frente dos sabores de chocolate e café; a produção de sabores de baunilha é estimada em 25.000 toneladas por ano.
usar
- A vanilina é usada por suas propriedades aromatizantes, sozinha ou como componente de um aroma . Não deve ser usado demais no aroma, pois em altas doses tem um sabor amargo. Vanilina ( Fema GRAS número 3107) é usada na criação de sabores de baunilha, chocolate e banana .
- É um produto intermediário para a produção de diversos derivados para uso farmacêutico.
- Suas propriedades químicas às vezes o tornam usado em certas reações em química analítica , em particular na forma de sulfovanilina .
- Também é creditado com virtudes afrodisíacas .
- Vanilina sulfúrica (mistura em ácido sulfúrico concentrado) é usada para medir terpenos por colorimetria
- A vanilina também é usada como aditivo em líquidos para cigarros eletrônicos.
Notas e referências
- CRC Handbook of Tables for Organic Compound Identification , Third Edition, 1984, ( ISBN 0-8493-0303-6 ) .
- massa molecular calculada de " pesos atômicos dos elementos 2007 " em www.chem.qmul.ac.uk .
- (en) ChemIDplus , " Vanillin USAN - RN: 121-33-5 " , em chem.sis.nlm.nih.gov , US National Library of Medicine (acessado em 6 de outubro de 2008 )
- (em) Carl L. Yaws, Handbook of Thermodynamic Diagrams: Organic Compounds C8 a C28 , vol. 3, Huston, Texas, Gulf Pub. Co.,1996, 396 p. ( ISBN 0-88415-859-4 )
- (em) WG Ungerer, Drug and Chemical Markets , Vol. 9, Mercados de drogas e produtos químicos,30 de novembro de 1921( leia online ) , p. 1127-1128
- Théodore N. Gobley , Jornal de farmácia e química: contendo o trabalho da Sociedade de Farmácia de Paris: uma revisão médica , vol. 34, Doin,1858( leia online ) , p. 401-405
- (De) F. Tiemann e W. Haarmann , " Ueber das Coniferin und seine Umwandlung in das aromatische Princip der Vanille " , Berichte der deutschen chemischen Gesellschaft , vol. 7, n o 1,1874, p. 608-623 ( DOI 10.1002 / cber.187400701193 )
- (de) K. Reimer , " Ueber eine neue Bildungsweise aromatischer Aldeído " , Berichte der Deutschen Chemischen Gesellschaft , Vol. 9, n o 1,1876, p. 423-424 ( DOI 10.1002 / cber.187600901134 )
- (em) GA bardana (2005). Manual de ingredientes de sabor de Fenaroli. Quinta edição. CRC Press. ( ISBN 0849330343 ) p. 1880-1881
- (en) GA Burdock (2005). Manual de ingredientes de sabor de Fenaroli. Quinta edição. CRC Press. ( ISBN 0849330343 ) p. 639-640
- Artigo em "Bilan"
-
Douglass F, Patel S, Travis M, Emma E, Winkel, Vanillin Synthesis from 4-Hydroxybenzaldehyde, J. Chem.
Ed., 2007: 84 (7): página 1158, DOI: 10.1021 / ed084p1158 - Mammou Faiza, “ SÍNTESE, ESTUDOS CINÉTICOS E AVALIAÇÃO DA ACTIVIDADE DOS DERIVADOS DE EUGENOL. COMPOSIÇÃO DE ÓLEO ESSENCIAL EXTRAÍDO DO CLOU DE CLOU DE CLOU DE CLOU DE CLOU DE CLOU DE CLROFLE ” , no repositório institucional da Universidade Abou Bekr Belkaid Tlemcen UABT ,1 ° de julho de 2016(acessado em 28 de fevereiro de 2021 )
- Gary M. Lampman , Jennifer Andrews , Wayne Bratz e Otto Hanssen , “ Preparação de vanilina a partir de eugenol e serragem ”, Journal of Chemical Education , vol. 54, n o 12,Dezembro de 1977, p. 776 ( ISSN 0021-9584 e 1938-1328 , DOI 10.1021 / ed054p776 , lido online , acessado em 13 de maio de 2020 )
- (in) C. Maugans e C. Ellis , " Wet Air Oxidation: A Review of Commercial Sub-Critical Hydrothermal Treatment " , Vigésima Primeira Conferência Internacional Anual sobre Incineração e Tecnologias de Tratamento Térmico ,13 a 17 de maio de 2002( leia online )
- Asther, M., Lesage-Meessen, L., Stentelaire, C., & Thibault, JF (1998). Cogumelos de baunilha . Biofutur, 1998 (178), 32-34.
- Oddou J (2000) Desenho e extrapolação de um processo microbiano para a produção de vanilina natural a partir de subprodutos da indústria alimentar (dissertação de doutorado).
- Stentelaire, C. (1999). Controle das vias metabólicas dos fungos envolvidos na biotransformação da fração feruloíla de coprodutos agrícolas em vanilina natural (dissertação de doutorado)
- Micard, V., Renard, CMGC, Thibault, JF, & Lesage-Meesen, L. (1995). É possível obter vanilina natural da polpa de beterraba? . Conferência Inra, 149-149.
- Shivaji L. Bhanawase e Ganapati D. Yadav (2017), Novel Silica-Encapsulated Cu - Al Hydrotalcite Catalyst: Oxidative Decarboxylation of Vanillyl Mandelic Acid to Vanillin in Water at Atmospheric Pressure ; Ind. Eng. Chem. Res., Artigo ASAP; DOI: 10.1021 / acs.iecr.6b04982 ( resumo )
- Uma maneira mais ecológica de fazer baunilha , publicado por Katherine Kornei em 17 de março de 2017 (Notícias da revista Science)
- " Vanilla and Vanillin " , em http://www.societechimiquedefrance.fr
Artigo relacionado
- Vanilloid
- Isovanilina
- Etilvanilina
links externos
- (pt) Electronic Plant Information Center no Royal Botanic Gardens, Kew 2003-11-8
- (fr) A cristalização da vanilina
- (en) Compound Display 1183 banco de dados NCBI
- (en) COMPOSTO: C00755 www.Genome.net


