Poliedro de coordenação
A noção de poliedro de coordenação é usada em cristalografia e química para descrever o ambiente de uma espécie química por seus ligantes em um cristal ou complexo . É o poliedro formado por ligantes em torno das espécies químicas centrais. O número de coordenação , ou seja, o número de ligantes, não é suficiente para descrever o ambiente de uma espécie química, pois para um determinado número de coordenação podem haver poliedros de coordenação múltiplos. Por exemplo, no estado sólido, o cobre tem um número de coordenação 4 de oxigênio no silicato de bário e cobre BaCuSi 2 O 6e também uma coordenação de enxofre 4 na estanita Cu 2 FeSnS 4, mas seu poliedro de coordenação é um quadrado CuO 4 em BaCuSi 2 O 6e um tetraedro CuS 4 em estanita.
Em solução, a noção de coordenação é freqüentemente reduzida à coordenação de cátions (os ânions são coordenados com uma energia de ligação fraca que não dá boa estabilidade à estrutura). A coordenação é definida, como no estado sólido, pelo ambiente do cátion em sua primeira esfera de coordenação . Isso é definido pelos ligantes (opcionalmente o solvente ) que estão diretamente ligados ao cátion. Esses ligantes são orientados geometricamente e sua ligação é razoavelmente forte, de modo que as trocas com as entidades da segunda esfera de coordenação são lentas. Esta segunda esfera é composta principalmente de moléculas de solvente, mas não exclusivamente, que são orientadas pela presença do cátion, mas que trocam (1) rapidamente com as moléculas de solvente que são externas a ele, e (2) lentamente com os ligantes que são internos a ele. A geometria da coordenação de um cátion em solução é menos variada do que no estado sólido. Com ligantes comuns, a maioria dos cátions metálicos adota coordenação octaédrica, uma pequena parte adota coordenação tetraédrica ou de plano quadrado e os metais na coluna de cobre no grau de oxidação I têm coordenação dois (linear). Destes, o íon diammina prata Ag (NH 3 ) 2+ (também denominado reagente de Tollens ) é o mais conhecido. As outras coordenadas resultam da presença de ligantes específicos (por exemplo, volumosos) ou de grandes cátions metálicos ( Ta , W , etc. )
Os poliedros de coordenação possíveis para uma dada espécie química e seus ligantes dependem do grau de oxidação da espécie química e dos raios iônicos envolvidos , mais precisamente da razão em que está o raio iônico da espécie química central e o raio de seus ligantes.
Os poliedros de coordenação geralmente não são regulares. Por exemplo, no caso de complexos, eles podem apresentar uma deformação devido à configuração eletrônica do cátion metálico no campo cristalino criado pelos ligantes. Este é o caso do Cu (H 2 O) 62+ que apresenta uma distorção axial explicada pelo Efeito Jahn-Teller . Outro caso de irregularidade é o da natureza química diferente dos ligantes, como no Cu (NH 3 ) 4 (H 2 O) 22+ . Em todos os casos, entretanto, é costume usar o nome de poliedros regulares para descrever a coordenação de espécies químicas.
Os diferentes poliedros de coordenação
Os poliedros de coordenação são geralmente compostos de faces triangulares equiláteras, como tetraedro , octaedro , bipiramide trigonal ou icosaedro . Também encontramos frequentemente faces quadradas, como na pirâmide tetragonal, cubo ou cuboctaedro . É mais raro encontrar poliedros de coordenação cujas faces tenham um grande número de vértices .
A tabela a seguir fornece os poliedros de coordenação encontrados em complexos em solução e em cristais:
| Coordenação | Poliedro | Representação | Exemplos: estrutura molecular | Exemplos: estado sólido |
|---|---|---|---|---|
| 2 | linear | Cu no íon dimetilcuprato (I) (CH 3 ) 2 Cu- | Ag em dicianoargentato de potássio (I) KAg (CN) 2 |
|
| 3 | triângulo |  |
B em trifluoreto de boro BF 3 | NO 3 no salitre KNO 3 , BO 3 , CO 3 na calcita CaCO 3 |
| 4 | tetraedro | 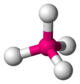 |
Ni em tetracarbonilníquel (0) Ni (CO) 4 | SiO 4 em quartzo SiO 2 , BO 4 |
| quadrado | 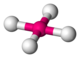 |
Ni no íon tetracianoniquelato (II) Ni (CN) 42− | Cu em CuO | |
| 5 | bipiramide trigonal |
 |
Fe em pentacarbonilfer (0) Fe (CO) 5 | K em K 3 Sb |
|
pirâmide tetragonal |
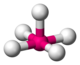 |
Nenhuma estrutura de corrente simples, mas é uma estrutura clássica intermediária em uma substituição em um complexo plano-quadrado (pela adição do ligante de entrada) ou em uma substituição em um complexo octaédrico (após a partida do ligante de saída) | V em CaV 4 O 9, Ti na fresnoita Ba 2 (TiO) Si 2 O 7 |
|
| 6 | octaedro | 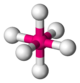 |
Ti no íon hexaaquatitânio (II) Ti (H 2 O) 62+ | Na e Cl em NaCl, Ti em BaTiO 3 (estrutura de perovskita ), Ni em breithauptita NiSb |
|
prisma triangular ou trigonal |
 |
Sb em breithauptite | ||
| 7 |
bipirâmide pentagonal |
 |
U no íon UO 2 (H 2 O) 5 2+ | Pa em PaCl 5 |
| octaedro de rosto coberto |
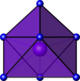 |
La em A-La 2 O 3 | ||
| prisma trigonal de face quadrada coberta |
||||
| 8 | cubo | 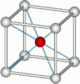 |
Cs e Cl em CsCl | |
|
antiprisma quadrado ou tetragonal |
 |
|||
|
bipiramide hexagonal |
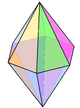 |
N em Li 3 N | ||
| disfenóide amolecido |
 |
Zr em K 2 ZrF 6 | ||
| prisma trigonal com duas faces triangulares cobertas |
||||
| prisma trigonal com duas faces quadradas cobertas |
 |
Ca em CaFe 2 O 4 | ||
| 9 | prisma trigonal com três faces quadradas cobertas |
 |
Pr em PrZr 3 F 15, Sr em SrCl 2 6H 2 O |
|
| antiprisma quadrado com rosto quadrado coberto |
 |
La in LaTe 2 | ||
| 10 | antiprisma quadrado com faces cobertas |
|||
| 11 | ||||
| 12 | icosaedro |  |
Cr em Mg 3 Cr 2 Al 18 | |
| cuboctaedro |  |
Os átomos na estrutura de metal tipo face cúbica compactada centrada |
||
|
hexagonal orthobicupola ou anticuboctahedron |
 |
Átomos em metais com uma estrutura do tipo empilhamento compacto hexagonal |
||
| prisma hexagonal |
 |
Rb em Rb 2 (VO) 2 [Si 8 O 19 ] |
Determinação de um poliedro de coordenação
Na prática, os poliedros de coordenação em materiais cristalinos são frequentemente determinados a partir de experimentos de raios-X , nêutrons ou difração de elétrons . Métodos espectroscópicos como a espectrometria de absorção de raios X também podem fornecer informações sobre o ambiente de espécies químicas, especialmente quando elas estão em solução líquida ou em um material amorfo .
No caso de complexos metálicos sintetizados em solução, a coordenação não está totalmente estabelecida até que a estrutura cristalográfica tenha sido resolvida. É então interessante analisar as diferenças entre os ângulos do poliedro base (por exemplo, o octaedro) e os ângulos realmente observados. Freqüentemente, são devidos a restrições estéricas. O mesmo é verdadeiro para as distâncias cátion-ligante. A distorção das distâncias para ligantes de tamanho comparável pode ser interpretada pelo efeito Jahn Teller. Este é freqüentemente o caso do cobre (II). A geometria mais simétrica em solução, que é geralmente aceita em boa concordância com os dados de NMR, é apenas uma média entre as diferentes formas que são trocadas entre si pela vibração da esfera de complexação.
Os poliedros de coordenação são geralmente descritos em publicações científicas pelo comprimento das ligações químicas entre o cátion central M e seus ligantes X, e pelos ângulos entre essas ligações. O comprimento das ligações depende das espécies químicas consideradas: em um tetraedro de SiO 4 , as ligações de Si-O normalmente têm um comprimento de 1,60 Å , enquanto as ligações BO médias em um tetraedro de BO 4 variam entre 1,44 Å e 1, 53 Å . Por esse motivo, primeiro usamos os ângulos de ligação para determinar o poliedro de coordenação. Os comprimentos de ligação são mais úteis para calcular o número de coordenação eficaz de um átomo ou para contabilizar a multiplicidade da ligação entre o cátion metálico e um ligante.
Quando há uma deformação do poliedro de coordenação, ou seja, quando os ângulos de ligação observados se desviam muito dos valores esperados para um poliedro regular, nem sempre é fácil reconhecer o poliedro de imediato. Por exemplo, o poliedro de coordenação CuO 5 do cobre pode ser uma pirâmide tetragonal no supercondutor YBa 2 Cu 3 O 7ou uma bipiramide trigonal em olivenita Cu 4 (AsO 4 ) 2 (O), mas é tão distorcido em Cu 2 P 2 O 7que ele está a meio caminho entre os dois. O cálculo dos ângulos diédricos do poliedro de coordenação, entre as normais com duas faces adjacentes, permite em certos casos difíceis tirar a dúvida. Cada aresta do poliedro de coordenação corresponde a um ângulo diedro. A tabela a seguir fornece os ângulos de ligação e os ângulos diédricos para alguns poliedros de coordenação idealizados, para os quais todos os comprimentos de ligação MX são iguais (os poliedros de coordenação não são necessariamente regulares, veja o caso da bipirâmide trigonal).
| Poliedro | Ângulos de ligação XMX | Ângulos diédricos |
|---|---|---|
| quadrado | 90 ° (× 4) | 0 ° (× 4) |
| tetraedro | 109,5 ° (× 4) | 109,5 ° (× 6) |
| pirâmide tetragonal | 90 ° (× 8) | 0 ° (× 1), 75,7 ° (× 4), 119,8 ° (× 4) |
| bipiramide trigonal | 120 ° (× 3), 90 ° (× 6) | 53,1 ° (× 3), 101,5 (× 6) |
| cubo | 70,5 ° (× 12) | 90 ° (× 12) |
| octaedro | 90 ° (× 12) | 70,5 ° (× 12) |
Fatores que determinam poliedros de coordenação
Para uma espécie química central e seus ligantes dados, o número de poliedros de coordenação possíveis é restringido por vários fatores, relacionados às regras de Pauling .
Influência dos raios iônicos
| Poliedro | Quociente Crítico |
|---|---|
| triângulo equilátero |
|
| tetraedro | |
octaedro quadrado |
|
| prisma trigonal |
|
| antiprisma tetragonal |
|
| cubo | |
| icosaedro | |
| cuboctaedro, anticuboctaedro |
Em uma descrição geométrica simplificada, as espécies químicas do núcleo (geralmente um cátion ) e seus ligantes (geralmente ânions ) são consideradas bolas duras de raios iônicos e , respectivamente. Esta descrição é especialmente válida para ligantes monoatômicos. No caso de ligantes poliatômicos como as bipiridinas , pode ser possível considerar apenas átomos em contato direto com as espécies químicas centrais; no entanto, a forma da molécula de ligante influenciará o tamanho do poliedro coordenador.
Os ligantes estão em contato com as espécies químicas centrais. Eles também podem afetar outros ligantes adjacentes, mas não necessariamente. O tamanho do sítio formado pelos ligantes em contato em um poliedro de coordenação dá um limite inferior para o tamanho do cátion que ali se aloja. Um cátion não pode se alojar no sítio formado pelos ligantes se seu tamanho for menor que o do sítio, pois neste caso não está em contato direto com os ligantes: prevalecem as repulsões eletrostáticas entre os ligantes. E a estrutura cristalina é não está mais estável.
O cálculo do quociente dos raios iônicos permite determinar o provável poliedro de coordenação de uma espécie química: basta comparar com os quocientes “críticos” para todos os poliedros de coordenação. Além disso , o poliedro de coordenação considerado não é mais estável e é provável que as espécies químicas adotem o ambiente com quociente crítico superior. Por exemplo, no caso do quartzo SiO 2 , o cátion Si 4+ tem um raio iônico de 0,41 Å e o ânion O 2– tem um raio iônico de 1,40 Å , o quociente é 0,293 e o silício poliedro de coordenação é, portanto, um SiO 4 tetraedro .
Poliedros de coordenação de quociente crítico alto geralmente correspondem à coordenação alta, no entanto, a coordenação não aumenta necessariamente com o quociente crítico: o quadrado (coordenação 4) e o octaedro (coordenação 6) têm o mesmo quociente crítico.
O quociente crítico é uma característica do poliedro de coordenação considerado e pode ser calculado com exatidão de forma simples.
Considere, por exemplo, o caso de coordenação do tipo plano quadrado.
Os centros dos ligantes formam um quadrado ao lado . Basta determinar a borda do poliedro de coordenação e sua meia diagonal em função dos raios iônicos e :
Substituindo por sua expressão como uma função de , obtemos
daí o quociente crítico
O método de cálculo do quociente crítico apresentado aqui para o quadrado também funciona para os outros poliedros de coordenação.
Influência dos graus de oxidação
A mudança no grau de oxidação de uma espécie química afeta seu poliedro de coordenação. O efeito do grau de oxidação no ambiente químico não é trivial. Por outro lado, um cátion com alto grau de oxidação tenderá a atrair um grande número de ânions para compensar as cargas eletrostáticas. Por outro lado, o raio iônico de um cátion diminui quando ele perde mais elétrons , favorecendo um poliedro de coordenação com um quociente crítico menor. Finalmente, para o mesmo grau de oxidação, uma espécie química pode ter vários poliedros de coordenação diferentes.
No entanto, existem correlações entre o grau de oxidação e o poliedro de coordenação, especialmente para metais de transição :
- caso de vanádio :
- o cátion V 3+ tem uma coordenação octaédrica de ânions O 2– ;
- o cátion V 4+ , de spin 1/2, pode estar em coordenação piramidal tetragonal ou octaédrica de O 2– ;
- o cátion V 5+ pode estar em coordenação tetraédrica, tetragonal piramidal ou octaédrica de O 2– ;
- caixa de cobre :
- o poliedro de coordenação do cátion Cu + é linear (grupos CuO 2 no cuprite Cu 2 O, o semicondutor YBa 2 Cu 3 O 6) Ou tetraédricos (CUS 4 grupos em Cu 2 FeSnS 4 stannite);
- o poliedro de coordenação do cátion Cu 2+ (spin 1/2) é muitas vezes um plano quadrado (grupos CuO 4 em BaCuSi 2 O 6), uma pirâmide tetragonal (grupos CuO 5 no supercondutor YBa 2 Cu 3 O 7), um octaedro (grupos CuCl 4 (H 2 O) 2em mitscherlichita K 2 CuCl 4 2H 2 O) ou, mais raramente, uma bipiramide trigonal (grupos CuO 5 em olivenita Cu 4 (AsO 4 ) 2 (O)) No caso do Cu 2+ , o efeito Jahn-Teller leva a uma forte deformação do poliedro de coordenação além do quadrado.
Para complexos em solução, a influência do grau de oxidação é freqüentemente interpretada com argumentos orbitais. Por exemplo, a coordenação do cobre (II) é um octaedro deformado (alongamento da simetria D 4h devido ao efeito Jahn Teller). Este é o caso, por exemplo, de Cu (NH 3 ) 4 (H 2 O) 22+ . Em contraste, o cobre (I) tem coordenação linear. Este é o caso dos organocupratos de Cu (CH 3 ) 2- . Acontece o mesmo para a prata (I) com o reagente de Tollens Ag (NH 3 ) 2+ e complexos de ouro (I).
Deformação de um poliedro de coordenação
A deformação de um poliedro de coordenação MX n é dada principalmente pelo desvio dos ângulos de ligação XMX daqueles dos poliedros idealizados e pela distribuição do comprimento da ligação, mas também pela distribuição da distância entre os ligantes.
Coordenação tetraédrica
Três parâmetros adimensionais são comumente usados para descrever a deformação de um tetraedro MX 4 :
- BLD ( distorção do comprimento da ligação ):
- AD ( distorção angular ):
- ELD ( distorção do comprimento da borda ):
Notas e referências
- (in) LW Finger , RM Hazen e RJ Hemley , " BaCuSi 2 O 6: Um novo ciclosilicato com anéis tetraédricos de quatro membros ” , Am. Mineral. , vol. 74, n osso 7-8,1989, p. 952-955 ( ler online )
- (en) SR Hall , JT Szymanski e JM Stewart , “ Kesterite, Cu 2 (Zn, Fe) SnS 4, e estanita, Cu 2 (Fe, Zn) SnS 4, minerais estruturalmente semelhantes, mas distintos ” , Can. Mineral. , vol. 16, n o 21978, p. 131-137
- Esta tabela foi extraída em parte do artigo em inglês Coordination geometry em sua versão de 5 de novembro de 2010 .
- (em) JL Hoard , " The crystal structure of silver potassium cyanide " , Zeitschrift für Kristallographie, Kristallgeometrie, Kristallphysik, Kristallchemie , vol. 84,1933, p. 231-255
- (en) JK Nimmo e BW Lucas , " A difração de nêutrons determinação da estrutura cristalina da fase α de nitrato de potássio a 25 graus C e 100 graus C " , J. Phys. C: Solid State Phys. , vol. 6, n o 21973, p. 201-211 ( DOI 10.1088 / 0022-3719 / 2/6/001 )
- (em) H. Chessin , WC Hamilton e B. Post , " Posição e parâmetros térmicos de átomos de oxigênio em calcita " , Acta Cryst. , vol. 18, n o 4,1965, p. 689-693 ( DOI 10.1107 / S0365110X65001585 )
- Miessler e Tarr, p.423.
- (De) R. Brill , C. Hermann e Cl. Peters , “ Studien über chemische Bindung mittels Fourieranalyse III. Die Bindung im Quarz ” , Naturwissenschaften , vol. 27, n o 40,1939, p. 676-677 ( DOI 10.1007 / BF01494994 , leia online )
- Miessler e Tarr, p.424.
- (em) S. Åsbrink e LJ Norrby , “ Um refinamento da estrutura cristalina do óxido de cobre (II) com uma discussão de alguns esd's excepcionais ” , Acta Cryst. B , vol. 26, n o 1,1970, p. 8-15 ( DOI 10.1107 / S0567740870001838 )
- (em) ARHF Ettema e RA de Groot , " Cálculos de estrutura de banda das fases hexagonal e cúbica de K 3 Sb " , J. Phys.: Condens. Matter , vol. 11, n o 3,1999, p. 759-766 ( DOI 10.1088 / 0953-8984 / 11/3/015 , ler online )
- Miessler e Tarr, p.375.
- J.-C. Bouloux e J. Galy , “ Crystal structure of the hypovanadate CaV 4 O 9 », Acta Cryst. B , vol. 29, n o 6,1973, p. 1335-1338 ( DOI 10.1107 / S0567740873004462 )
- (em) Paul B. Moore e S. John Louisnathan , " The crystal structure of fresnoite, Ba 2 (TiO) If 2 O 7 " , Z. Kristall. , vol. 130, n osso 1-61969, p. 438-448 ( DOI 10.1524 / zkri.1969.130.1-6.438 , ler online )
- (De) M. Straumanis e A. Ieviņš , “ Die Gitter konstanten des NaCl und des Steinsalzes ” , Zeitschrift für Physik , vol. 102, n osso 5-6,1936, p. 353-359 ( DOI 10.1007 / BF01339176 )
- (in) FJ Gotor , C. Real , MJ Dianez e JM Criado , " Relações entre a textura e a estrutura do BaTiO 3 e sua Cúbica Tetragonal → Entalpia de Transição " , J. Solid State Chem. , vol. 123, n o 21996, p. 301-305 ( DOI 10.1006 / jssc.1996.0183 )
- (em) Robert Leubolt , Herbert IPSER , Peter Terzieff e Kurt L. Komarek , " Nonstoichiometry in B8-type NiSb " , Z. Anorg. Allg. Chem. , vol. 533, n o 21986, p. 205-214 ( DOI 10.1002 / zaac.19865330226 )
- R. Souane (2005) Propriedades de síntese e complexação em relação ao íon uranila de derivados carboxílicos de p-terc-butil-calix [6] areno. Tese de doutorado da Universidade L. Pasteur em Estrasburgo. p.90 http://scd-theses.u-strasbg.fr/933/01/these-souane.pdf
- (em) RP Dodge , GS Smith , Q. Johnson e RE Elson , " The crystal structure of protactinium pentachloride " , Acta Cryst. , vol. 22, n o 1,1967, p. 85-89 ( DOI 10.1107 / S0365110X67000155 )
- P. Aldebert e JP Traverse , “ Estudo de difração de nêutrons de estruturas de alta temperatura de La 2 O 3e Nd 2 O 3 ”, Materials Research Bulletin , vol. 14, n o 3,Março de 1979, p. 303-323 ( DOI 10.1016 / 0025-5408 (79) 90095-3 )
- (in) Wheeler P. Davey , " Precision Measurements of Alkali Halides of the Crystals " , Phys. Rev. , vol. 21, n o 21923, p. 143-161 ( DOI 10.1103 / PhysRev.21.143 )
- (en) Takeshi Asai , Kunio Nishida e Shichio Kawai , " Síntese e condutividade iônica de Cu x Li 3-x N ” , Materials Research Bulletin , vol. 19, n o 10,Outubro de 1984, p. 1377-1381 ( DOI 10.1016 / 0025-5408 (84) 90203-4 )
- (de) R. Hoppe e B. Mehlhorn , “ Die Kristallstruktur von K 2 ZrF 6 » , Z. Anorg. Allg. Chem. , vol. 425, n o 3,1976, p. 200-208 ( DOI 10.1002 / zaac.19764250303 )
- (em) BF Decker e JS Kasper , " The structure of cálcio ferrite " , Acta Cryst. , vol. 10, n o 4,1957, p. 332-337 ( DOI 10.1107 / S0365110X5700095X )
- (en) JP Laval e A. Abouz , " Crystalochemical of anion-excess ReO 3 related article phase : Crystal structure of β-PrZr 3 F 15 » , J. Solid State Chem. , vol. 96, n o 21992, p. 324-331 ( DOI 10.1016 / S0022-4596 (05) 80266-X )
- (em) AP Agron e WR Busing , " Cálcio e dicloreto de estrôncio hexahidratos por difração de nêutrons " , Acta Cryst. C , vol. 42, n o 21986, p. 141-143 ( DOI 10.1107 / S0108270186097007 )
- (em) WB Pearson , " The Cu 2 Sb and related structure " , Z. Kristall. , vol. 171 n ossos 1-2,1985, p. 23-29 ( DOI 10.1524 / zkri.1985.171.1-2.23 )
- (em) S. Samson , " A estrutura cristalina do composto intermetálico Mg 3 Cr 2 Al 18 » , Acta Cryst. , vol. 11, n o 12,1958, p. 851-857 ( DOI 10.1107 / S0365110X58002425 )
- (en) Sebastian Prinz , Karine M. Sparta e Georg Roth , " The diphyllosilicate Rb 2 (VO) 2 [Si 8 O 19 ] » , Acta Cryst. C , vol. 64, n o 3,2007, i27-i29 ( DOI 10.1107 / S0108270107068205 )
- (De) Th. Hahn , " Silikate - Struktur, Eigenschaften und Technische Nutzung " , Fakultät für Bergbau und Hüttenwesen der RWTH-Aachen, Technische Mitteilungen , vol. 56, n o 12,1963, p. 501-509
- (de) E. Zobetz , " Geometrische Größen und für einfache Modellrechnungen BO 4 -Gruppen " , Z. Kristall. , vol. 191, n osso 1-2,1990, p. 45-57 ( DOI 10.1524 / zkri.1990.191.1-2.45 )
- C. Michel e B. Raveau , “ Óxidos Um 2 BaCuO 5(A = Y, Sm, Eu, Gd, Dy, Ho, Er, Yb) ”, J. Solid State Chem. , vol. 43, n o 1,1982, p. 73-80 ( DOI 10.1016 / 0022-4596 (82) 90216-X )
- (en) BE Robertson e C. Calvo , " The Crystal Structure and Phase Transformation of α-Cu 2 P 2 O 7 » , Acta Cryst. , vol. 22, n o 5,1967, p. 665-672 ( DOI 10.1107 / S0365110X6700132X )
- (in) EL Muetterties e LJ Guggenberger , " Idealized Polytopal Forms. Description of Real Molecules Referenced to Idealized Polygons or Polyhedra in Geometric Reaction Path Form ” , J. Am. Chem. Soc. , vol. 96, n o 6,1974, p. 1748-1756 ( DOI 10.1021 / ja00813a017 )
- (pt) RD Shannon , " Effective ionic radii Revised and Syndrome Studies of Interatomic distance in halogenides and Chalcogenides " , Acta Cryst. A , vol. 32,1976, p. 751-767 ( DOI 10.1107 / S0567739476001551 )
- (in) Schindler , FC Hawthorne e WH Baur , " Crystal Chemical Aspects of Vanadium: Polyhedral Geometries, Characteristic Bond valences, and Polymerization of (VO n ) Polyhedra " , Chem. Mater. , vol. 12, n o 5,2000, p. 1248-1259 ( DOI 10.1021 / cm990490y , leia online )
- (en) A. Restori e D. Schwarzenbach , " densidade de carga em cuprite, Cu 2 O " , Acta Cryst. B , vol. 42, n o 3,1986, p. 201-208 ( DOI 10.1107 / S0108768186098336 )
- (en) Mary F. Garbauskas , RW Green , RH Arendt e JS Kasper , " Investigação por raios-X de cuprato de bário de ítrio YBa 2 Cu 3 O 6 » , Inorg. Chem. , vol. 27, n o 5,1988, p. 871-873 ( DOI 10.1021 / ic00278a024 )
- (em) B. Renner e G. Lehmann , " Correlação de distorção angular em comprimento e salto para 4 unidades em cristais " , Z. Kristall. , vol. 175, n osso 1-2,1986, p. 43-59 ( DOI 10.1524 / zkri.1986.175.1-2.43 )















![{\ displaystyle {\ begin {array} {l} a = 2r_ {a} \\ [1ex] \ displaystyle {\ frac {a {\ sqrt {2}}} {2}} = r_ {a} + r_ { c} \ end {array}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7d21c80ce20a5840896f192edd5cdad19813e2f6)








