Dióxido de enxofre
| Dióxido de enxofre | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  Estrutura do dióxido de enxofre. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identificação | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nome IUPAC | dióxido de enxofre | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sinônimos |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o ECHA | 100.028.359 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o EC | 231-195-2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o RTECS | WS4550000 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | 1119 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ChEBI | 18422 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o E | E220 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| FEMA | 3039 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SORRISOS |
O = S = O , |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI |
InChI: InChI = 1 / O2S / c1-3-2 InChIKey: RAHZWNYVWXNFOC-UHFFFAOYAT Padrão. InChI: InChI = 1S / O2S / c1-3-2 Padrão InChIKey: RAHZWNYVWXNFOC-UHFFFAOYSA-N |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aparência | gás incolor ou gás liquefeito comprimido, com odor pungente | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades quimicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fórmula bruta | S O 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massa molar | 64,064 ± 0,006 g / mol O 49,95%, S 50,05%, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Momento dipolar | 1,63305 D | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Diâmetro molecular | 0,382 nm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades físicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fusão T ° | -75,5 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° fervendo | −10 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solubilidade | em água a 25 ° C : 85 ml · l -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Parâmetro de solubilidade δ | 12,3 J 1/2 · cm -3/2 ( 25 ° C ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
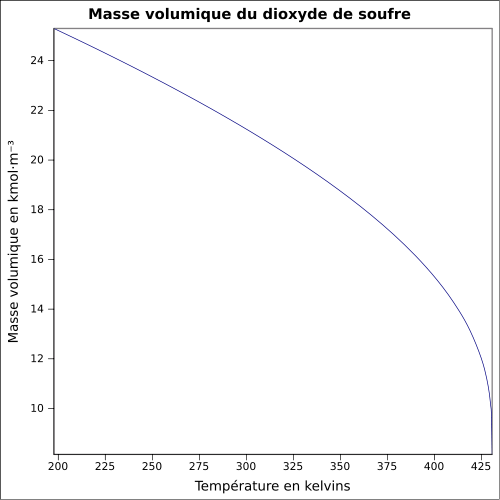
| Massa volumica |
1,354 g · cm -3 a -30 ° C 1,434 g · cm -3 a 0 ° C 1,25 g · ml -1 a 25 ° C 2,26 a 21 ° C em relação ao ar equação:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Temperatura de autoignição | não inflamável | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de inflamação | não inflamável | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Limites explosivos no ar | não explosivo | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pressão de vapor de saturação |
-10 ° C : 1,013 bar 20 ° C : 3,3 bar 40 ° C : 4,4 bar equação:

|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto crítico | 78,9 bar , 157,45 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidade do som | 213 m · s -1 ( 0 ° C , 1 atm ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termoquímica | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| S 0 gás, 1 bar | 248,21 J / mol K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ f H 0 gás | -296,84 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ vap H ° |
24,94 kJ · mol -1 ( 1 atm , -10,05 ° C ); 22,92 kJ · mol -1 ( 1 atm , 25 ° C ) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| C p |
equação:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades eletrônicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 energia de re ionização | 12,349 ± 0,001 eV (gás) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades ópticas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Índice de refração | 1.357 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Precauções | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
   Perigo H314, H331, H314 : Provoca queimaduras na pele e lesões oculares graves H331 : Tóxico por inalação |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| WHMIS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
   A, D1A, E, A : Pressão absoluta de vapor de gás comprimido a 50 ° C = 900 kPa D1A : Material muito tóxico com efeitos imediatos graves Transporte de mercadorias perigosas: classe 2.3 E : Material corrosivo Transporte de mercadorias perigosas: classe 8 Divulgação a 1,0% de acordo com a divulgação do ingrediente Lista |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NFPA 704 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 0 3 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Transporte | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
268 : gás venenoso e corrosivo Número ONU : 1079 : DIÓXIDO DE ENXOFRE Classe: 2.3 Rótulos: 2.3 : Gases tóxicos (corresponde a grupos designados por T maiúsculo, ou seja, T, TF, TC, TO, TFC e TOC). 8 : Substâncias corrosivas   |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Classificação IARC | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo 3: inclassificável quanto à sua carcinogenicidade para humanos | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Inalação | Muito tóxico, morto, produz ácido sulfuroso nos pulmões. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pele | Perigoso, corrosivo, formação de ácido em contato com superfícies molhadas. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Olhos | Perigoso, corrosivo, formação de ácido em contato com superfícies molhadas. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ingestão | Toxicidade relativamente baixa, efeitos de longo prazo desconhecidos. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ecotoxicologia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CL 50 | 3000 ppm por 30 min (mouse, inalação) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Limiar de odor | baixo: 0,33 ppm alto: 5 ppm |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unidades de SI e STP, salvo indicação em contrário. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
O dióxido de enxofre , anteriormente também conhecido como dióxido de enxofre , é um composto químico de fórmula SO 2. É um gás incolor, denso e tóxico, cuja inalação é altamente irritante. É liberado na atmosfera terrestre por vulcões e por diversos processos industriais , bem como pela combustão de certos carvões , óleos e gases naturais não dessulfurados . A oxidação do dióxido de enxofre, geralmente na presença de catalisadores como o dióxido de nitrogênio NO 2, leva a trióxido de enxofre SO 3e ácido sulfúrico H 2 SO 4, daí a formação de chuva ácida . Isso resulta em inflamação do sistema respiratório.
O dióxido de enxofre é usado como desinfetante , anti-séptico , antibacteriano , gás refrigerante , alvejante, gás catalisador para núcleos de fundição no processo Ashland e como conservante para produtos alimentícios , especialmente para frutas secas , na produção de bebidas alcoólicas e na fabricação de vinho .
Estrutura da molécula
SO 2é uma molécula curvada na qual o átomo de enxofre está no estado de oxidação +4. Do ponto de vista da teoria molecular orbital , a maioria dos electrões de valência estão envolvidos numa S = O laço .
O comprimento das ligações S = O de SO 2é 143,1 µm , menor do que esta ligação em monóxido de enxofre SO ( 148,1 µm ).
Por analogia, O - O bônus em ozono O 3( 127,8 pm ) são mais longos do que em oxigênio O 2( 120,7 µm ).
Da mesma forma, a energia de ligação média é maior em SO 2( 548 kJ mol −1 ) do que em SO ( 524 kJ mol −1 ), embora seja menor em O 3( 297 kJ mol −1 ) do que em O 2( 490 kJ mol −1 ).
Essas considerações levaram os químicos a concluir que as ligações S = O do dióxido de enxofre têm uma ordem de ligação pelo menos igual a 2, ao contrário das ligações OO do ozônio, que são da ordem de 1,5.
Produção
O dióxido de enxofre pode ser preparado:
- por combustão de enxofre elementar:
- por combustão de sulfeto de hidrogênio ou compostos organossulfurados :
- torrando minerais de sulfureto, como pirita , esfalerita ou cinábrio :
- como um produto residual da produção de cimento : CaSiO 3e CaSO 4são aquecidos com coque e areia ( dióxido de silício ):
- por ácido sulfúrico quente em limalha de cobre
O dióxido de enxofre dissolvido na água é um ácido bifuncional e é dividido em três frações de acordo com os seguintes balanços:
H 2 O + SO 2 H + + HSO 3 - 2H + + SO 3 2- .Essas frações dependem das constantes termodinâmicas e do pH do vinho.
Uma liberação de SO 2 também é obtidamisturando metabissulfito de sódio Na 2 S 2 O 5com ácido tartárico em água, um experimento oferecido por certos experimentos introdutórios de química.
Propriedades físicas
Pressão de vapor de saturação:
| Temperatura | -103,15 ° C | -98,15 ° C | -93,15 ° C | -88,15 ° C | -83,15 ° C | -78,15 ° C | -73,15 ° C | -68,15 ° C | -63,15 ° C |
|---|---|---|---|---|---|---|---|---|---|
| Pressão | 0,1 kPa | 0,2 kPa | 0,3 kPa | 0,5 kPa | 0,8 kPa | 1,3 kPa | 2,0 kPa | 3,0 kPa | 4,4 kPa |
| Temperatura | −58,15 ° C | −53,15 ° C | −48,15 ° C | -43,15 ° C | -38,15 ° C | -33,15 ° C | -28,15 ° C | -23,15 ° C | -18,15 ° C |
|---|---|---|---|---|---|---|---|---|---|
| Pressão | 6,3 kPa | 9,0 kPa | 12,6 kPa | 17,3 kPa | 23,3 kPa | 31,1 kPa | 40,9 kPa | 53,2 kPa | 68,3 kPa |
| Temperatura | -13,15 ° C | -8,15 ° C | -3,15 ° C | 1,85 ° C | 6,85 ° C | 11,85 ° C | 16,85 ° C | 21,85 ° C | 26,85 ° C |
|---|---|---|---|---|---|---|---|---|---|
| Pressão | 86,7 kPa | 109 kPa | 136 kPa | 168 kPa | 205 kPa | 249 kPa | 300 kPa | 359 kPa | 426 kPa |
Na industria
Na indústria, o dióxido de enxofre é usado principalmente para a produção de ácido sulfúrico . Este último tem inúmeras aplicações e é o produto químico mais amplamente utilizado sozinho ou em combinação com outras substâncias, como o cloreto de tionila SOCl 2. O dióxido de enxofre é obtido pela combustão de enxofre ou pirita e , em seguida, transformado em trióxido de enxofre (SO 3) muito puro por oxidação com ar, catalisada por pentóxido de platina ou vanádio . SO 3 assim obtido permite a fabricação direta de ácido sulfúrico altamente concentrado por hidratação simples.
A poluição do ar por dióxido de enxofre proveniente da indústria vem principalmente do consumo de combustíveis fósseis. Na verdade, o enxofre está naturalmente contido nesses combustíveis e sua combustão gera SO 2.. Também pode vir da indústria metalúrgica , dos processos de fabricação do ácido sulfúrico, da conversão da polpa de madeira em papel, da incineração do lixo e da produção de enxofre elementar.
A combustão do carvão é a fonte sintética mais importante e é responsável por cerca de 50% das emissões anuais globais. O do petróleo ainda representa 25 a 30%.
As liberações industriais de dióxido de enxofre podem ser reduzidas implementando processos de dessulfuração .
No ambiente
SO 2natural é produzido por vulcões .
O dióxido de enxofre desempenha um papel refrescante para o planeta, pois serve como núcleo de nucleação de aerossóis de albedo bastante elevado, ou seja, refletindo os raios solares sem absorvê-los, mas esse efeito não dura apenas alguns anos, onde o de CO 2 chegou ao século.
A última grande erupção do Pinatubo liberou até 5.000 t de SO 2no ar (17 Mt no total, a maior quantidade já medida por instrumentos modernos), que afetou a camada de ozônio e mudou o clima ao resfriar significativamente o planeta e alterar as chuvas por pelo menos dois anos. Deve-se notar, entretanto, que em 1986 as emissões antropogênicas dos Estados Unidos somente (17,1 Mt ) eram comparáveis a esta emissão recorde do Pinatubo.
Os defensores da geoengenharia consideram o SO 2como um meio de travar o aquecimento global, para "condicionar" o planeta. Esse método foi abandonado porque também poderia ter consequências dramáticas. Na verdade, quando o dióxido de enxofre se combina com a água e o oxigênio atmosférico causando chuva ácida , que perturba ou até destrói ecossistemas frágeis. O dióxido de enxofre , junto com o dióxido de nitrogênio, é uma das principais causas da chuva ácida. Além disso, SO 2leva à acidificação dos oceanos, o que coloca em risco a existência de plânctons, animais com conchas calcárias e recifes de coral. No entanto, os plânctons produzem metade do oxigênio terrestre necessário para humanos e animais.
Poluente do ar
O dióxido de enxofre tem sido um dos principais poluentes da atmosfera desde o início da revolução industrial , devido às grandes quantidades de carvão, depois petróleo e gás queimados pelo homem, principalmente no hemisfério norte . Tem efeitos significativos na saúde pública .
Além disso, a concentração de dióxido de enxofre no ar degrada os ecossistemas: é um acidificante crônico das chuvas e a acidificação de solos e sedimentos promove a liberação de metais tóxicos (metais pesados, metalóides, radionuclídeos, etc. ) bem como sua biodisponibilidade .
As emissões de dióxido de enxofre são (junto com os nitratos ) precursores da chuva ácida, mas também contribuem para a formação de aerossóis atmosféricos que modificam significativamente o clima. Em grande parte graças ao programa Acid Rain Program (in) da Environmental Protection Agency , os Estados Unidos estiveram entre os maiores emissores registrando uma redução de 33% das emissões de 2002 a 1983. Essa melhora deveu-se principalmente à dessulfurização de gases de combustão, tecnologia que permite enxofre a ser recuperado dos gases de combustão de usinas de carvão e petróleo , em particular, reagindo com cal para formar sulfito de cálcio:
CaO + SO 2→ CaSO 3Oxidação aeróbia de CaSO 3dá CaSO 4, anidrita .
A maior parte do gesso vendido na Europa agora vem da dessulfurização dos gases de combustão.
Em uma caldeira de leito fluidizado industrial, o enxofre pode ser removido do carvão no momento da combustão adicionando calcário como material no leito. Isto é referido como "combustão em leito fluidizado".
O enxofre também pode ser removido de certos combustíveis (petróleo, gás) antes mesmo da combustão, o que evita a formação de SO 2quando o combustível é queimado e protege as instalações dos efeitos corrosivos do enxofre. O processo Claus é usado em refinarias para produzir enxofre como subproduto . O processo Stretford também tem sido usado para remover o enxofre do combustível. Os processos baseados em uma reação redox baseada em óxidos de ferro podem finalmente ser usados, por exemplo, o processo “Lo-Cat”.
A utilização obrigatória de combustíveis sem enxofre para determinadas utilizações permitiu reduzir as quantidades emitidas para a atmosfera a partir da década de 1970, mas as isenções concedidas ao transporte marítimo e a certas indústrias explicam as emissões que continuam a ser elevadas. Também no início do XXI th século, China e Índia, pela queima de grandes quantidades de carvão, permanecem grandes emissores de gases de enxofre. Certos aditivos de combustível (por exemplo, à base de carboxilato de cálcio e magnésio) podem ser usados em motores marítimos para reduzir as emissões de dióxido de enxofre na atmosfera.
Em 2006 , a China era o maior poluidor de dióxido de enxofre do mundo, principalmente para produzir bens de consumo para uso em outros países (“emissões cinza”). Em 2005, as emissões chinesas foram estimadas em 23,1 Mt , quase comparáveis às dos Estados Unidos em 1980, e estavam aumentando drasticamente (crescimento de mais de 27% em cinco anos de 2000 a 2005). Para sofrer menos com a precipitação ácida da China, o Japão decidiu em 2007 ajudá-lo a desenvolver energias limpas .
Na industria alimentícia
É amplamente utilizado na área de alimentos e agronegócios e é encontrado principalmente em:
- vinhos, principalmente rosés e brancos, que possuem menos taninos que os vinhos tintos e, portanto, sofrem uma oxidação mais forte. O dióxido de enxofre torna possível reduzir isso;
- vinagres;
- os frutos secos;
- carnes, geléias usadas em carnes frias, cervejas e outras bebidas fermentadas;
- confeitaria, compotas, frutas cristalizadas, geleias, marmeladas, xaropes, etc.
Em vinificação
No vinho, o dióxido de enxofre está presente na forma livre hidratada: H 2 SO 3ou ácido sulfuroso , que combina 2/3 com os constituintes do vinho. Portanto, temos SO 2total = SO 2grátis + SO 2 combinado.
Parte da porção livre atua como protetor do vinho contra microrganismos que o deterioram. Esta porção é chamada de SO 2ativo ou SO 2molecular. SO 2pode estar na forma combinada com aldeídos (etanal), cetonas (ácido alfa-cetoglutárico) e certos açúcares para dar um composto estável. O corpo formado pela combinação entre o dióxido de enxofre e o etanal é o ácido aldeído-sulfuroso ou ácido etanolsulfônico, que é um ácido forte , de acordo com a seguinte reação:
CH 3 CHO + NaH SO 3 → CH 3 CHOH-O-SO 2 NaDependendo da dose, o dióxido de enxofre inibe ou interrompe o desenvolvimento de leveduras e bactérias , que podem ser utilizadas para a mutação de vinhos doces ou xaroposos, ou simplesmente para garantir a preservação do vinho. Durante a vinificação, a introdução do dióxido de enxofre permite selecionar as leveduras da espécie Saccharomyces cerevisiae que são mais resistentes ao dióxido de enxofre do que as leveduras de outros gêneros como Pichia anomala (en) (syn. Hansenula ). Existem vários métodos analíticos para medir SO 2 em vinhos.
Saúde e regulamentação
O dióxido de enxofre ou E220 causaria um perigo para a saúde nos seguintes casos:
- durante sua inalação;
- quando ingerido;
- em contato com a pele e membranas mucosas.
Durante sua ingestão, os órgãos que exibem as atividades de sulfito oxidase mais altas têm maior probabilidade de desintoxicar-lo pela urina. A persistência de derivados SO 2pode ser considerado por uma ingestão excessiva. Para o usuário, os sulfitos são nucleófilos muito poderosos que não causam nenhuma toxicidade aguda, mas podem causar alergias fortes ou graves. Ele destrói a vitamina B 1 (ou tiamina ) em torno de pH = 6, podendo causar irritação gástrica, a ser evitada em pacientes renais. Assim, a ADI estabelecida pela OMS é de 0,7 mg kg −1 de peso corporal por dia.
Na maioria dos casos, os sintomas aparecem poucos minutos após a ingestão de alimentos contendo sulfitos. Poluição do ar por SO 2também desempenharia um papel no aparecimento dessas reações de intolerância. Além disso, as pessoas com asma são muito mais sensíveis do que a média das pessoas.
Regulamentos europeus agora produtores obrigam a indicar "Contém sulfitos" se está numa concentração de mais de 100 mg L -1 . No Canadá, o SAQ limita a concentração a 50 ppm de dióxido de enxofre no estado livre e 300 ppm de dióxido de enxofre no estado combinado.
No contexto atual, onde o respeito ao meio ambiente e os alimentos orgânicos são cada vez mais defendidos, os produtores de vinho e até mesmo os consumidores tendem agora a recorrer aos vinhos orgânicos com teor de SO 2.são menos, mas para os quais o uso de SO 2permanece autorizado. Observe que, em comparação com outros países do mundo (Canadá, Suíça ou Estados Unidos), as regras de incorporação do SO 2durante a vinificação são muito mais restritivas, ainda mais severas na Europa. Os produtores de vinhos naturais procuram reduzir ao máximo a adição de dióxido de enxofre.
A tabela a seguir mostra as diferenças notáveis nas concentrações de SO 2 total nestes diferentes países:
| SO 2 em mg / l | NOP (EUA) “ Feito com uvas orgânicas ” SO 2 total |
Bio Canada | Gema suíço | Demeter SO 2 total (5 anos) |
|---|---|---|---|---|
| Vermelho seco (açúcar < 5 g l -1 ) |
100 | 100 | 120 | 70 |
| rosé branco / seco (açúcar < 5 g l -1 ) |
100 | 100 | 120 | 90 |
| rosé branco / seco (açúcar < 5 g l -1 ) |
100 | 150 | 170 | 70 |
| Branco / rosé (açúcar> 5 g l -1 ) |
100 | 150 | 170 | 130 |
| Vinho licoroso (açúcar> 5 g l -1 ) |
100 | 250 | 170 | 80 |
Grandes incidentes na França
O 22 de junho de 2011por 7 h 45 , um problema técnico para o fecho de uma válvula na refinaria Feyzin (pertencente ao grupo total ) deixar sair uma grande nuvem dióxido de enxofre empurrado por um vento sul acima do Lyon . Várias pessoas foram hospitalizadas e as empresas evacuadas.
A prefeitura , que procurou tranquilizar a população, recomendou "ventilar as casas e os escritórios" , dando instruções contrárias às dos bombeiros que aconselhavam "ficar em casa e fechar as janelas" .
Notas e referências
- DIÓXIDO DE ENXOFRE , ficha (s) de segurança do Programa Internacional de Segurança Química , consultada em 9 de maio de 2009.
- (em) David R. Lide, Handbook of Chemistry and Physics , Boca Raton, CRC,16 de junho de 2008, 89 th ed. , 2736 p. ( ISBN 978-1-4200-6679-1 ) , p. 9-50.
- (en) Itzhak Marcus, As propriedades dos solventes , vol. 4, Inglaterra, John Wiley & Sons,1999, 239 p. ( ISBN 0-471-98369-1 ).
- massa molecular calculada de " pesos atômicos dos elementos 2007 " em www.chem.qmul.ac.uk .
- (en) Robert H. Perry e Donald W. Green , Perry's Chemical Engineers 'Handbook , EUA, McGraw-Hill,1997, 7 th ed. , 2400 p. ( ISBN 0-07-049841-5 ) , p. 2-50.
- (em) " Propriedades de vários gases " em flexwareinc.com (acessado em 12 de abril de 2010 ) .
- (em) W. M Haynes, Handbook of Chemistry and Physics , CRC, 2010-2011 91 th ed. , 2610 p. ( ISBN 9781439820773 ) , p. 14-40.
- (em) Irvin Glassman e Richard A. Yetter, Combustion , Amsterdam / Boston, Elsevier,2008, 4 th ed. , 773 p. ( ISBN 978-0-12-088573-2 ) , p. 6.
- (em) David R. Lide, CRC Handbook of Chemistry and Physics , CRC Press,2009, 90 th ed. , 2804 p. , Capa dura ( ISBN 978-1-4200-9084-0 ).
- (em) David R. Lide, Handbook of Chemistry and Physics , Boca Raton, CRC,2008, 89 th ed. , 2736 p. ( ISBN 978-1-4200-6679-1 ) , p. 10-205.
- “Dióxido de enxofre” , em ESIS (acessado em 13 de fevereiro de 2009).
- Grupo de Trabalho IARC sobre a Avaliação de Riscos Carcinogênicos para Humanos , " Avaliações de Carcinogenicidade Global para Humanos, Grupo 3 : inclassificável quanto à sua carcinogenicidade para humanos " , em monographs.iarc.fr , IARC,16 de janeiro de 2009(acessado em 22 de agosto de 2009 ) .
- índice Número na Tabela 3.1 do anexo VI do Regulamento CE n o 1272/2008 [PDF] , 16 de dezembro, 2008.
- " Dióxido de enxofre " na base de dados de produtos químicos Reptox da CSST (Organização de Quebec responsável pela segurança e saúde ocupacional), acessada em 23 de abril de 2009.
- (em) " Dióxido de enxofre " em hazmap.nlm.nih.gov (acessado em 14 de novembro de 2009 ) .
- (in) AF Holleman e E. Wiberg, " Inorganic Chemistry ", Academic Press , San Diego, 2001 ( ISBN 0-12-352651-5 ) .
- (em) Norman N. Greenwood e A. Earnshaw, " Chemistry of the Elements ", Butterworth-Heinemann 2 e ed. , p. 700 , Oxford, 1997 ( ISBN 0-08-037941-9 ) .
- (em) David R. Lide, CRC Handbook of Chemistry and Physics , CRC Press,2009, 90 th ed. , 2804 p. , Hardcover ( ISBN 978-1-4200-9084-0 ) , p. 6-105.
- Stephen Self et al. , The Atmospheric Impact of the 1991 Mount Pinatubo Eruption , Fire and Lahar: Eruptions and Lahars of Mount Pinatubo, Filipinas, 1997
- Dióxido de enxofre , EPA
- Hogan, C. Michael, “Abiotic factor” em Encyclopedia of Earth , 2010, Emily Monosson e C. Cleveland (eds), Conselho Nacional para a Ciência e o Ambiente, Washington DC.
- (in) Michael R. Lindeburg , Manual de referência de engenharia mecânica para o exame PE , Belmont, CA, Professional Publications, Inc.2006, 1296 p. ( ISBN 978-1-59126-049-3 ) , p. 27–3.
- Perguntas frequentes sobre a remoção e recuperação de enxofre usando o sistema de remoção de sulfeto de hidrogênio LO-CAT . gtp-merichem.com
- Análise de triagem de processo de tratamento alternativo de gás e remoção de enxofre para gaseificação [PDF] , dezembro de 2002, Relatório da SFA Pacific, Inc. preparado para o Departamento de Energia dos EUA (acessado em 31 de outubro de 2011).
- Maio, Walter R., Marine Emissions Abatement , SFA International, Inc., p. 6 .
- China tem seu pior período de chuva ácida , United Press International , 22 de setembro de 2006.
- Michel Temman, "Vítima de suas rejeições, Tóquio ajuda Pequim a se tornar verde", Liberation , 16 de abril de 2007, [ leia online ] .
- Centro Canadense de Saúde e Segurança Ocupacional .
- Leia online .
- Leia online .
- Regras de vinificação orgânica na França e no exterior [PDF] , em milleime-bio.com .
- Leia online .
- Leia online .
- Leia online , em 20minutes.fr .
Veja também
Artigos relacionados
links externos
- Instituto Francês do Meio Ambiente .
- Programa de informações sobre atmosfera, clima e meio ambiente do governo do Reino Unido.