Metanol
| Metanol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  Molécula de metanol |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identificação | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nome IUPAC | Metanol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sinônimos |
álcool metílico |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o ECHA | 100.000.599 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o EC | 200-659-6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | 887 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SORRISOS |
CO , |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI |
Padrão InChI: InChI = 1S / CH4O / c1-2 / h2H, 1H3 Std. InChIKey: OKKJLVBELUTLKV-UHFFFAOYSA-N |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aparência | líquido incolor com um odor característico | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades quimicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fórmula bruta |
C H 4 O [Isômeros] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massa molar | 32,0419 ± 0,0014 g / mol C 37,48%, H 12,58%, O 49,93%, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| pKa | 15,2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Momento dipolar | 1,70 ± 0,02 D | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Diâmetro molecular | 0,408 nm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades físicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fusão T ° | -98 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° fervendo | 65 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Parâmetro de solubilidade δ | 29,7 MPa 1/2 ( 25 ° C ); 12,9 cal 1/2 cm −3/2 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscibilidade | miscível em água e em acetona em qualquer proporção | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
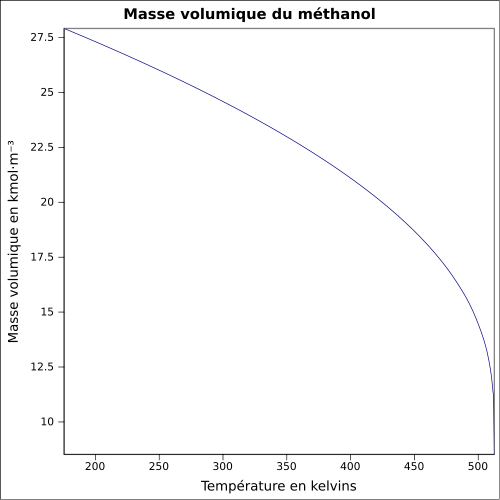
| Massa volumica |
0,791 0 g cm −3
equação:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Temperatura de autoignição | 464 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de inflamação | 12 ° C (copo fechado) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Limites explosivos no ar | Inferior: 6,7 Vol% Kohn-Birett Superior: 36,5 Vol% Kohn-Birett |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pressão de vapor de saturação | a 20 ° C : 12,3 kPa , 410 mmHg a 50 ° C equação:

|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Viscosidade dinamica | 0,551 3 mPa s a 25 ° C (líquido) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto crítico | 239,35 ° C , 8,08 MPa , 0,117 l mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Condutividade térmica | 190,16 mW m −1 K −1 a 25 ° C (líquido) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Condutividade elétrica | 5 × 10 −9 Ω −1 cm −1 a 25 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidade do som | 1.121 m s −1 a 20 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termoquímica | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| S 0 gás, 1 bar | 186,9 J mol −1 K −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| S 0 líquido, 1 bar | 127,19 J mol −1 K −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| S 0 sólido | 1,117 J mol −1 K −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ f H 0 gás | −201,54 kJ mol −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ f H 0 líquido | −239,00 kJ mol −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| C p |
79,5 J mol −1 K −1
equação:
equação:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PCS | 726,1 kJ mol −1 ( 25 ° C , líquido) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades eletrônicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 energia de re ionização | 10,85 ± 0,01 eV (gás) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cristalografia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Classe de cristal ou grupo espacial | P212121 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Parâmetros de malha |
a = 4,873 Å b = 4,641 Å |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volume | 200,53 Å 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades ópticas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Índice de refração | 1,3265 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Precauções | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
   Perigo H225, H301, H311, H331, H370, H225 : Líquido e vapor facilmente inflamáveis H301 : Tóxico por ingestão H311 : Tóxico em contato com a pele H331 : Tóxico por inalação H370 : Risco demonstrado de danos graves aos órgãos (ou liste todos os órgãos afetados, se conhecido) (indicar a rota de exposição se está provado de forma conclusiva que nenhuma outra via de exposição leva ao mesmo perigo) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| WHMIS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  B2, D1B, D2A, D2B, B2 : Ponto de inflamação do líquido inflamável = 11,1 ° C copo fechado Método Setaflash D1B : Material tóxico com efeitos imediatos graves Transporte de mercadorias perigosas: classe 6.1 grupo de embalagem indeterminado D2A : Material muito tóxico causando outros efeitos tóxicos teratogenicidade em animais; embriotoxicidade em animais D2B : Material tóxico causando outros efeitos tóxicos Irritação nos olhos em animais Divulgação a 0,1% de acordo com os critérios de classificação |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NFPA 704 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3 1 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Transporte | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
336 : líquido altamente inflamável e tóxico Número UN : 1230 : METANOL Classe: 3 Rótulos: 3 : Líquidos inflamáveis 6.1 : Substâncias tóxicas Embalagem: Grupo de embalagem II : substâncias moderadamente perigosas;   |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Inalação | tóxico, pode ser fatal | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pele | secando | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Olhos | cortinas perigosas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ecotoxicologia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LogP | -0,82 / -0,66 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Limiar de odor | baixo: 4,2 ppm alto: 5960 ppm |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unidades de SI e STP, salvo indicação em contrário. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
O metanol (ou álcool metílico , carbinol , álcool de madeira , nafta de madeira ou álcool de madeira ) é um composto orgânico de fórmula : C H 3 OH (freqüentemente abreviado como MeOH). É o mais simples dos álcoois . É um líquido leve, volátil , incolor , inflamável , tóxico e de odor característico, mais doce e mais doce que o do etanol (álcool etílico).
À temperatura ambiente, esse líquido polar serve como anticongelante (para refrigerante, por exemplo), solvente, combustível (em aeromodelos ou autopistas ) e como álcool etílico desnaturante . Esses dois álcoois, no entanto, permanecem dissociáveis por destilação. Com efeito, a temperatura de ebulição do metanol é de apenas 65 ° C , enquanto que o etanol é de 79 ° C . O metanol também é usado para produzir biodiesel por uma reação de transesterificação .
O metanol é produzido naturalmente pelo metabolismo de organismos anaeróbios de muitas variedades de bactérias, o que explica uma pequena fração do vapor de metanol presente na atmosfera. Em poucos dias, esse metanol atmosférico é oxidado pelo oxigênio do ar com a ação promotora da luz solar para formar dióxido de carbono e água.
O metanol queima no ar formando dióxido de carbono e água:
2 CH 3 OH+ 3 O 2→ 2 CO 24 + H 2 O.
Sua chama quase incolor e invisível é fonte de risco de queimaduras.
Por suas propriedades tóxicas, o metanol é frequentemente utilizado como aditivo desnaturante do etanol fabricado para uso industrial, essa adição de um veneno permite que os fabricantes de etanol economizem no pagamento de impostos incidentes sobre as bebidas alcoólicas.
Diz-se que é “álcool de madeira” porque costumava ser um subproduto da destilação da madeira. O principal método de síntese requer várias etapas : o gás natural e o vapor d'água são "reformados" em um forno para produzir hidrogênio e monóxido de carbono. O hidrogênio e o monóxido de carbono em uma mistura de gás de alta pressão reagem juntos na presença de um catalisador para produzir metanol.
História
Em seu processo de embalsamamento , os antigos egípcios usavam um grande número de substâncias, incluindo metanol, obtido por pirólise da madeira. No entanto, o metanol puro não foi isolado pela primeira vez até 1661 por Robert Boyle , que lhe deu o nome de aguardente da madeira , porque era produzido pela destilação , ou pirólise da madeira . Mais tarde, ficou conhecido como o espírito da pirólise . Em 1834 , os químicos franceses Jean-Baptiste Dumas e Eugène-Melchior Péligot determinaram sua composição elementar. Eles também introduzida a palavra de metileno em química orgânica, formado a partir do grego palavras metil = vinho + Hyle = madeira (casca de árvore) . Originalmente, significava " álcool feito de madeira", mas houve um erro no uso do grego. O termo derivado "metil" apareceu por volta de 1840 como uma abreviatura da palavra metileno , e mais tarde foi usado para descrever "álcool metílico". Este termo foi então alterado para "metanol" em 1892 pela Conferência Internacional sobre a Nomenclatura dos Produtos Químicos. O sufixo -il, que é usado na química orgânica para formar os nomes dos radicais , é derivado da palavra "metil".
Em 1923, o químico alemão Matthias Pier , trabalhando para a BASF, desenvolveu um processo para converter o gás de síntese (uma mistura de óxidos de carbono - monóxido e dióxido - e hidrogênio ) em metanol. Este método utiliza o cromato de zinco (en) como catalisador , e requer condições de extrema pressão, que variam de 30 de para 100 MPa (300 a 1000 atmosferas ), e temperaturas muito elevadas da ordem de 400 ° C . A produção moderna de metanol tornou-se mais eficiente com o uso de catalisadores (geralmente cobre ) capazes de atuar em baixa pressão.
O uso do metanol como combustível despertou grande interesse durante as crises do petróleo da década de 1970 devido à sua disponibilidade e baixo custo. Os problemas surgiram muito rapidamente no desenvolvimento de misturas de gasolina-metanol. Devido ao seu baixo preço, alguns comercializam combustível contendo muito metanol. Outros usaram técnicas de manipulação e mistura inadequadas.
Em 2006, os astrônomos usando o MERLIN radiotelescópio no Observatório Jodrell Bank descobriu uma nuvem de metanol no espaço com um diâmetro de cinco cem bilião km, cerca de 25 vezes o diâmetro do sistema solar (20.000 milhões km). Em 2017, foi detectado metanol na nuvem de Magalhães , ou seja, fora da Via Láctea .
Fontes naturais e antropogênicas
Plantas
As plantas em crescimento produzem pequenas quantidades de metanol, que variam com as plantas, a estação e as condições de crescimento.
Trabalho recente (2008) sugere que as estimativas anteriores, bem como a ligação entre o nível de metanol no ar e a densidade das plantas, foram superestimadas até agora, tanto para zonas temperadas (de acordo com medições feitas na América do Norte) como para a trópicos de acordo com outros estudos in situ .
- O viés norte-americano (superestimativa - talvez por um fator de 4 - dos estudos anteriores a 2008) parece estar relacionado a variações em áreas cultivadas e florestadas de madeira de lei. Em 2008, segundo esses estudos, a estimativa global para as usinas seria na verdade para a América do Norte 80 Tg / ano emitidos para a atmosfera, mas essa estimativa ainda precisa ser refinada, pois variações locais significativas são observadas e mais mal explicadas. Os autores nos convidam a fazer medições mais detalhadas e definir os fatores que influenciam sua produção ( ex: tipo funcional da planta, estação, fitossanidade / estresse), a fim de melhor compreender o ciclo do metanol na biosfera.
Uma observação é que na América do Norte o nível de metanol no ar está muito correlacionado no verão com o de monóxido de carbono na camada limite , apesar da ausência de uma fonte significativa de metanol antropogênico. A modelagem reproduz as correlações e inclinações observadas na América do Norte, dadas as restrições independentes das emissões de CO (Hudman et al. , 2008), o que apóia a ideia de que as fontes biogênicas terrestres são fracas.
- Em 2008, a fonte global de metanol foi reavaliada em 242 Tg / ano (incluindo 85 Tg / ano para a biosfera marinha, ou quase três vezes menos do que as fontes terrestres), 103 Tg / ano viriam do crescimento e desintegração de plantas terrestres, 37 Tg / ano da química atmosférica, enquanto 12 Tg / ano viriam da combustão de biomassa e biocombustíveis, por apenas 5 Tg / ano de fontes urbanas e industriais.
- Segundo dados de 2008, a vida útil do metanol na atmosfera seria de cerca de cinco dias (duas vezes menos do que o estimado anteriormente). E é o oceano o melhor sumidouro de metanol do ar; 42% do metanol na atmosfera desaparece aí. Além disso, a oxidação na fase gasosa (pelo íon OH) degrada 36%. 17% são encontrados no solo na forma de depósitos secos e 5% na forma de depósitos úmidos.
Metabolismo animal
O metanol está naturalmente presente em organismos animais (incluindo humanos), plantas e alimentos.
Também é produzido por fermentação e degradação de compostos orgânicos (folha) e via metabolismo animal.
A principal fonte de metanol para os humanos é sua dieta, ao consumir frutas e vegetais frescos, sucos de frutas, bebidas fermentadas e alimentos com baixo teor de gordura contendo aspartame .
| Comida | Concentração de metanol |
|---|---|
| Cerveja | 6 - 27 mg l -1 |
| Vinho | 96 - 321 mg l -1 |
| Espíritos | 10 - 220 mg l -1 |
| Vinagre | 10 - 100 mg l -1 |
| suco de laranja | 11 - 80 mg l −1 (média de 34 mg l −1 ) |
| Suco de toranja | 13 - 40 mg l −1 (média de 27,4 mg l −1 ) |
| Suco de tomate | > 100 mg l -1 |
Em geral, o nível de metanol nos sucos frescos aumenta durante o armazenamento. A variação depende, em sucos de frutas frescas, do tipo de fruta e da atividade de duas enzimas : pectinesterase (en) e pectato liase (en) . Em sucos de vegetais, a variação no teor de metanol está ligada à atividade da enzima pectinesterase, ao pH e à acidez total.
Produção e síntese
Como o metanol não está presente em grandes quantidades na natureza, ele deve ser produzido industrialmente. Existem várias rotas sintéticas a partir das moléculas mais acessíveis contendo um único átomo de carbono: CO e CO 2. Isso é o que Igor Tkatchenko já chamava na década de 1980 de química das moléculas C1. Síntese de CO 2seria uma forma de valorizar esse gás produzido em grandes quantidades, mas ainda não está desenvolvido. A produção de metanol é, portanto, feita a partir de CO e H 2 . A questão é, portanto, produzir CO, que também não está presente na natureza.
A produção de monóxido de carbono tem sido bem estudada devido à sua mistura com H 2é um bom combustível industrial chamado gás de síntese . É tradicionalmente produzido pela reação do vapor de água sobre o carbono incandescente (em alta temperatura):
C + H 2 S→ CO + H 2
No entanto, no início de XXI th século, o gás de síntese , isto é, a mistura de CO e H 2 , é normalmente produzido a partir do metano componente de gás natural , em vez de carvão. Três métodos são usados comercialmente. Em pressões moderadas de 1 a 2 MPa ( 10 a 20 atm ) e alta temperatura (aproximadamente 850 ° C ), o metano reage com o vapor de água na presença de um catalisador, níquel, para produzir gás de síntese , de acordo com a equação química :
Esta reação, conhecida como reforma a vapor do metano ou SMR, é endotérmica e os requisitos de transferência térmica impõem limites ao tamanho dos reatores em catálise utilizados. O metano também pode sofrer oxidação parcial por oxigênio molecular para produzir gás de síntese, conforme mostrado na seguinte equação:
Esta reação é exotérmica e o calor liberado pode ser usado in situ para iniciar a reação de reforma do metano a vapor. Quando os dois processos são combinados, é chamada de reforma autotérmica. A razão entre as quantidades de CO e H 2 pode ser ajustada usando a reação de deslizamento de vapor de água, para fornecer a estequiometria desejada para a síntese de metanol:
O monóxido de carbono e o hidrogênio então reagem sobre um segundo catalisador para produzir metanol. Hoje, o catalisador mais usado é uma mistura de cobre , óxido de zinco e alumina usada pela primeira vez pela ICI em 1966. A uma pressão de 5 a 10 MPa ( 50 a 100 atm ) e a uma temperatura de 250 ° C , pode catalisar a produção de metanol a partir de monóxido de carbono e hidrogênio muito seletivamente:
A produção de gás de síntese a partir do metano produz três moles de hidrogênio para cada mol de monóxido de carbono, enquanto a síntese do metanol consome apenas dois moles de hidrogênio para cada mol de monóxido de carbono. Uma maneira de compensar o excesso de hidrogênio é injetar dióxido de carbono no reator de síntese de metanol, onde também reage, para formar metanol de acordo com a equação química:
A francesa Air Liquide é líder mundial na engenharia de produção de metanol a partir do metano, ou seja, na prática, do gás natural. Na verdade, essa síntese consome grandes quantidades de dioxigênio, do qual a Air Liquide é um dos maiores produtores do mundo. A engenharia de grandes unidades é protegida pelo nome “Megametanol”. Várias unidades foram instaladas nos Estados Unidos em 2014, país onde o gás natural é muito barato e onde a produção de metanol é uma forma de valorizar o gás de xisto .
Embora o gás natural seja o produto mais econômico e amplamente utilizado, outras matérias-primas também podem ser usadas para produzir metanol. Onde o gás natural não estiver disponível, derivados de petróleo leve podem ser usados em seu lugar. A empresa sul-africana Sasol produz metanol usando gás de síntese a partir do carvão .
usar
O metanol é usado como solvente em vernizes, tintas, cimentos, tintas, anticongelantes, tintas, plásticos e diversas tintas industriais. Também é um combustível para foguetes.
Matéria-prima
De longe, o maior mercado para o metanol é seu uso como matéria-prima para a síntese de outros produtos químicos. Cerca de 40% do metanol é convertido em formaldeído , para ser transformado em produtos tão diversos como plásticos , resinas sintéticas (algumas das quais são utilizadas na fabricação de compensados ), tintas , explosivos e tecidos resistentes a rugas.
O metanol também é um dos componentes do processo de produção do álcool. Na verdade, pode ser comparado à indústria do álcool .
Além disso, no início dos anos 1970, o processo de metanol gasolina foi desenvolvido pela Mobil , que produz combustível para veículos. Uma unidade de produção industrial foi construída na Nova Zelândia na década de 1980 . Na década de 1990 , grandes quantidades de metanol foram usadas nos Estados Unidos para produzir um aditivo à gasolina éter metil terc-butílico (MTBE), apesar da deserção de muitos estados onde foi proibido. Além de seu uso direto como combustível, o metanol (ou mais raramente, o etanol ) é usado como componente na transesterificação de triglicerídeos para produzir uma forma de biodiesel .
Outros derivados químicos do metanol incluem o éter dimetílico , que substituiu os CFCs como propelente de aerossol , e o ácido acético .
Combustível automotivo
O metanol é usado em quantidades limitadas como combustível para motores de combustão interna , principalmente porque não é tão inflamável quanto a gasolina . O uso de metanol puro ou misto é imposto pelos regulamentos para certas corridas de automóveis, como era o caso nos Estados Unidos por razões de segurança na Champ Car ou IndyCar . O metanol é essencial para alguns motores dragster sobrealimentados . Alguns veículos usam misturas com etanol , gasolina ou óxido nitroso. O metanol é também o combustível utilizado pelo modelo de ar entusiastas para modelos rádio-controlados de aviões ou de speedway motocicletas , uma disciplina esporte motociclismo.
Uma das desvantagens do metanol como combustível é a corrosão de certos metais, especialmente o alumínio . O metanol, embora seja um ácido fraco, ataca a camada de óxido que normalmente protege o alumínio da corrosão. Para evitar a deterioração do motor e do carburador, é altamente recomendável tratar o hidrato de metila com um óleo especialmente desenvolvido para a proteção:
6 CH 3 OH+ Al 2 O 3→ 2 Al (OCH 3 ) 3+ 3 H 2 O
Os metóxidos produzidos são sais solúveis em metanol que gravam a superfície do alumínio, que é facilmente oxidado pelo oxigênio dissolvido. Assim, o metanol pode se comportar como um oxidante :
6 CH 3 OH+ 2 Al → 2 Al (OCH 3 ) 3+ 3 H 2
Este processo explica a corrosão pelo combustível até que o metal seja consumido ou a concentração de CH 3 OH tornou-se insignificante.
Quando produzido a partir de madeira ou outros materiais orgânicos, o metanol orgânico resultante ( bioálcool ) pode se tornar uma alternativa e uma alternativa renovável aos hidrocarbonetos à base de petróleo . No entanto, o metanol puro não pode ser usado em carros a gasolina modernos sem modificações no motor, devido a possíveis danos na tubulação de metal e nas vedações de borracha.
Outras aplicações
O metanol é tradicionalmente usado como desnaturante do etanol, o que explica a origem do termo álcool desnaturado .
O metanol também é utilizado como solvente , e como anticongelante em oleodutos e fluido de lavagem de pára - brisa (proibido neste último na Europa desde 2019).
Em algumas estações de tratamento de esgoto , uma pequena quantidade de metanol é adicionada à água residual para fornecer uma fonte de carbono para alimentar bactérias desnitrificantes , que convertem nitratos em nitrogênio .
Durante a Segunda Guerra Mundial , o metanol foi usado como combustível pelos militares alemães em vários modelos de foguetes, sob o nome de M-Stoff , e em uma mistura conhecida como C-Stoff .
O metanol é usado como agente desnaturante na eletroforese em gel de poliacrilamida .
As células a combustível movidas a metanol são as únicas utilizáveis a baixa temperatura, à pressão atmosférica, o que permite a miniaturização a um nível até então desconhecido. Essa característica, aliada ao armazenamento e manuseio relativamente simples e seguros do metanol, pode abrir caminho para células a combustível para o funcionamento de dispositivos eletrônicos, como laptops.
Saúde e segurança
O metanol é tóxico por dois mecanismos. Primeiro, o metanol (se entrar no corpo por ingestão , inalação , absorção pela pele ) pode resultar em morte devido às suas propriedades depressoras do sistema nervoso central da mesma forma que o etanol . Em segundo lugar, torna-se tóxico após ser metabolizado no fígado pela ação de uma enzima , a álcool desidrogenase, que o converte em formaldeído . Este é então metabolizado em ácido fórmico por uma aldeído desidrogenase ou formaldeído desidrogenase. Esses compostos são a causa da acidose metabólica, cegueira por destruição do nervo óptico , etc. Os tecidos fetais são muito sensíveis aos efeitos do metanol. A dose perigosa é atingida rapidamente se uma pessoa é regularmente exposta a vapores ou manipula líquidos sem proteção para a pele. Se o metanol foi ingerido, um médico deve ser contatado imediatamente. A dose letal comumente aceita é de 100 a 125 mL . Os efeitos tóxicos aparecem após várias horas, e antídotos eficazes podem muitas vezes evitar a ocorrência de danos irreversíveis. Este tratamento usa etanol ou fomepizole . Essas duas drogas têm o efeito de retardar a ação da álcool desidrogenase sobre o metanol pelo mecanismo de inibição competitiva , de modo que é excretado pelos rins , ao invés de transformado em metabólitos tóxicos.
Os primeiros sintomas de envenenamento por metanol são os sinais de depressão do sistema nervoso central : dor de cabeça, tontura, náusea, descoordenação, confusão, sonolência e, em altas doses, coma e morte. As primeiras manifestações de exposição ao metanol são geralmente menos graves do que os sintomas resultantes da ingestão de uma quantidade semelhante de álcool etílico .
Quando os primeiros sintomas desaparecem, novos sintomas aparecem dez a trinta horas após a primeira exposição ao metanol: redução ou perda total da visão, acompanhada de acidose . Esses sintomas são causados pelo acúmulo de formiato, atingindo níveis tóxicos no sangue e podem levar à morte por insuficiência respiratória . Os ésteres derivados do metanol não desempenham nenhum papel neste efeito tóxico.
O etanol às vezes é desnaturado (adulterado) e, portanto, tornado intragável pela adição de metanol. O resultado é conhecido como álcool desnaturado ou "metanfetamina" (uso no Reino Unido). (Este último não deve ser confundido com metanfetamina , uma abreviatura comumente usada para metanfetamina .)
O metanol puro tem sido usado em corridas de automóveis abertas desde meados dos anos 1960 . Ao contrário dos incêndios de petróleo, os incêndios de metanol podem ser extintos com água pura (embora o metanol seja menos denso que a água, as duas substâncias são miscíveis , e a adição de água ajuda a absorver o gás. Calor do fogo, devido à grande quantidade de calor necessário para vaporizar a água). Além disso, um fogo à base de metanol queima sem fumaça, ao contrário da gasolina, que queima com uma espessa fumaça preta. Em caso de incêndio na pista, não há liberação de fumaça que possa reduzir a visibilidade dos pilotos que chegam a toda velocidade ao local do acidente. A decisão de mudar para o metanol permanentemente na corrida do American Car Championship ( IndyCar ) foi consequência do devastador acidente e explosão na corrida de Indianápolis de 1964, que resultou na morte dos pilotos Eddie, Sachs e Dave MacDonald (em) .
Essas considerações sobre a adição de metanol a combustíveis automotivos foram destacadas pelo recente impacto sobre as águas subterrâneas de um aditivo de combustível, éter metil terc-butílico (MTBE). Um vazamento de tanques de armazenamento subterrâneo de gasolina fez com que o MTBE vazasse, causando a contaminação do lençol freático. A alta solubilidade do metanol em água dá origem a preocupações semelhantes sobre a possível contaminação da água que poderia surgir do uso generalizado de metanol como combustível automotivo.
Precauções
O metanol é uma substância muito tóxica. Seu consumo pode levar à cegueira e até à morte. O álcool adulterado às vezes é feito com metanol: quem bebe é menos sujeito à intoxicação (do que com etanol), mas o nervo óptico é afetado com certo risco de cegueira.
Antes de qualquer uso regular, consulte a ficha toxicológica do INRS .
Radiólise
A radiólise do metanol na presença de intensa radioatividade tem certas semelhanças com a da água.
Notas e referências
- METANOL , segurança folha (s) de Programa Internacional sobre a Segurança de Substâncias Químicas , consultado em 09 de maio de 2009
- (em) David R. Lide, Manual de Química e Física , CRC,16 de junho de 2008, 89 th ed. , 2736 p. ( ISBN 142006679X e 978-1420066791 ) , p. 9-50
- (em) Itzhak Marcus, As propriedades dos solventes , vol. 4, Inglaterra, John Wiley & Sons ,1999, 239 p. ( ISBN 0-471-98369-1 )
- massa molecular calculada de " pesos atômicos dos elementos 2007 " em www.chem.qmul.ac.uk .
- (em) James E. Mark, Physical Properties of Polymer Handbook , Springer,2007, 2 nd ed. , 1076 p. ( ISBN 978-0-387-69002-5 e 0-387-69002-6 , leia online ) , p. 294
- (em) Serban Moldoveanu, Preparação de amostra em cromatografia , Amsterdam / Boston, Elsevier ,2002, 930 p. ( ISBN 0-444-50394-3 ) , p. 258
- (em) JG Speight e Norbert Adolph Lange, Manual de Química de Lange , McGraw-Hill,2005, 16 th ed. , 1623 p. ( ISBN 0-07-143220-5 ) , p. 2.289
- (en) Robert H. Perry e Donald W. Green , Perry's Chemical Engineers 'Handbook , Estados Unidos, McGraw-Hill,1997, 7 th ed. , 2400 p. ( ISBN 0-07-049841-5 ) , p. 2-50
- (in) Claudio A. Faúndez e José O. Valderrama , " Activity Coefficient Models to Describe Vapor-Liquid Equilibrium in Ternary Hydro-Alcoholic Solutions " , Chinese Journal of Chemical Engineering , Vol. 17, n o 2abril de 2009, p. 259-267 ( DOI 10.1016 / S1004-9541 (08) 60203-7 )
- (em) WM Haynes, Handbook of Chemistry and Physics , CRC, 2010-2011 91 th ed. , 2610 p. ( ISBN 978-1-4398-2077-3 ) , p. 14-40
- (en) Irvin Glassman e Richard A. Yetter, Combustion , Amsterdam / Boston, Elsevier ,2008, 4 th ed. , 773 p. ( ISBN 978-0-12-088573-2 ) , p. 6
- (em) Carl L. Yaws, Handbook of Thermodynamic Diagrams: Organic Compounds C8 a C28 , vol. 1, 2 e 3, Huston, Texas, Gulf Pub. Co.,1996, 396 p. ( ISBN 0-88415-857-8 , 0-88415-858-6 e 0-88415-859-4 )
- (em) David R. Lide , CRC Handbook of Chemistry and Physics , Boca Raton, CRC Press,18 de junho de 2002, 83 th ed. , 2664 p. ( ISBN 0849304830 , apresentação online ) , p. 5-89
- (em) David R. Lide, Handbook of Chemistry and Physics , Boca Raton, CRC,2008, 89 th ed. , 2736 p. ( ISBN 978-1-4200-6679-1 ) , p. 10-205
- " Metanol " , em reciprocalnet.org (acessado em 12 de dezembro de 2009 )
- No Índice de na Tabela 3.1 do anexo VI do Regulamento CE n o 1272/2008 (16 de dezembro 2008)
- " Álcool metílico " no banco de dados de produtos químicos Reptox da CSST (Organização de Quebec responsável pela segurança e saúde ocupacional), acessado em 23 de abril de 2009
- " Álcool metílico " , em hazmap.nlm.nih.gov (acessado em 14 de novembro de 2009 )
- "metanol" , em ESIS (acessado em 18 de fevereiro de 2009)
- Paul Karrer , Tratado sobre química orgânica , Editions du Griffon,1948, p. 85.
- (en) Marta Sewiło, Remy Indebetouw, Steven B. Charnley Sarolta Zahorecz, Joana M. Oliveira et al. , " The Detection of Hot Cores and Complex Organic Molecules in the Large Magellanic Cloud " , The Astrophysical Journal Letters ,30 de janeiro de 2018( leia online )
- Millet, DB, Daniel J. Jacob, TG Custer, JA de Gouw, AH Goldstein, T. Karl, HB Singh, BC Sive, RW Talbot, C. Warneke e J. Williams (2008), Novas restrições sobre fontes terrestres e oceânicas de metanol atmosférico , Química e Física Atmosférica , 8 (23), 6887-6905, leia online ou leia online
- (en) HB Greizerstein , “ conteúdo congénere de bebidas alcoólicas ” , J. Stud. Álcool , n o 42,Mil novecentos e oitenta e um, p. 1030-1037
- (en) GP Blanch , J. Tabera , J. Sanz , M. Herraiz e G. Reglero , " Volatile composition of vinegars. Destilação-extração simultânea e análise de espectrometria de massa por cromatografia gasosa ” , J. Agric. Chem. , N o 40,1992, p. 1046-1049 ( DOI 10.1021 / jf00018a027 , leia online [PDF] )
- (en) ED Lund , CL Kirkland e PE Shaw , “ Metanol, etanol e conteúdo de acetaldeído de produtos cítricos ” , J. Agric. Food Chem. , N o 29,Mil novecentos e oitenta e um, p. 361-366 ( DOI 10.1021 / jf00104a034 , leia online [PDF] )
- (en) Chih-Yao Hou , Yeong-Shenn Lin , Yuh Tai Wang , Chii-Ming Jiang e Ming-Chang Wu , " Efeito das condições de armazenamento no conteúdo de metanol de sucos de frutas e vegetais " , Jornal de Composição de Alimentos and Analysis , vol. 21, n o 5,2008, p. 410-415 ( DOI 10.1016 / j.jfca.2008.04.004 )
- Leia online
- Relatório da assembleia geral de acionistas da Air Liquide, 6 de maio de 2015, Paris.
- " Metanol - Lista de restrições - ECHA " , em echa.europa.eu (acessado em 7 de julho de 2020 )
- (in) S Berger, " Methanol Fuel Laptop " , Hi-Tech & Gadgets em compukiss.com , Compu • Kiss30 de setembro de 2006(acessado em 22 de maio de 2007 )
- (in) Anonymous, " Methanol and Blindness " , Ask A Scientist , em newton.dep.anl.gov , Newtown,5 de setembro de 2005(acessado em 31 de outubro de 2008 )
- (em) MJ Casavant , " fomepizole in the Treatment of Poisoning " , Pediatrics , Vol. 107, n o 1,2001, p. 170 ( ISSN 0031-4005 , DOI 10.1542 / peds.107.1.170 , resumo , ler online [PDF] )
- Folha toxicológica , INRS
- C. e J. -P. Jay-Gerin, Some Current Aspects of Radiolysis of Liquid Methanol: A Review , Radiation Physics and Chemistry , vol. 48, n ° 4, outubro de 1996, p. 473-480, DOI : 10.1016 / 0969-806X (96) 00007-2 ; Química da radiação ( resumo , em francês e inglês)
Veja também
Artigos relacionados
Outros álcoois:
links externos
- Folha toxicológica , INRS
- Folha de Dados de Segurança Internacional
- (en) Critérios de Saúde Ambiental 196 Metanol
- (pt) Race Car Book , em RaceCarBook.com, inclui artigos técnicos e informações sobre o livro de corrida de metanol.
- (pt) Grupo comercial do Methanol Institute Industry, muitas informações sobre o uso do metanol em células a combustível e como combustível alternativo.
- (pt) A história do metanol: um combustível sustentável para o futuro , artigo de Roberta Nichols da Ford Motor, a mãe do veículo de combustível flexível, discutindo a flexibilidade Gasolina-Etanol-Metanol no Journal of Scientific & Industrial Research
Bibliografia
- (pt) Robert Boyle , The Skeptical Chymist , 1661 - contém o relato da destilação do álcool da madeira.
- Millet, DB, Daniel J. Jacob, TG Custer, JA de Gouw, AH Goldstein, T. Karl, HB Singh, BC Sive, RW Talbot, C. Warneke e J. Williams (2008), New constraints on terrestrial and oceanic sources de metanol atmosférico , Química e Física Atmosférica , 8 (23), 6887-6905, leia online ou leia online