Simetria molecular
A simetria molecular , em química , é descrever as simetrias presentes em uma molécula (ou um cristal ) e classificar as moléculas de acordo com sua simetria.
A simetria molecular é um conceito fundamental em química porque nos permite entender ou prever muitas propriedades químicas . Mobiliza ferramentas matemáticas como a noção de grupo , em particular de grupo de simetria e grupo de simetria de ponto .
A química molecular, a dos complexos de coordenação , o estudo dos orbitais moleculares , bem como a espectroscopia de entidades e complexos moleculares usam a notação Schoenflies para descrever a qual grupo de simetria de ponto uma molécula está ligada. Na cristalografia , os símbolos de Hermann-Mauguin são usados em seu lugar .
As operações de simetria podem ser representadas de várias maneiras . Isso pode ser feito por exemplo usando matrizes cujas colunas representam, para uma determinada base, as coordenadas dos novos vetores obtidos após a transformação dos vetores da base pela operação de simetria. O traço dessa matriz é denominado caráter da representação.
As representações irredutíveis do grupo são freqüentemente usadas, pois todas as outras representações do grupo podem ser descritas como somas diretas de representações irredutíveis (o teorema de Maschke ).
Uma operação de simetria é uma transformação geométrica que troca átomos equivalentes ou deixa átomos invariantes. Para cada grupo de pontos, uma tabela de caracteres resume as informações sobre as operações de simetria do grupo e suas representações irredutíveis. Podemos, assim, estabelecer uma lista de tabelas de caracteres úteis em química (en) . Nessas tabelas, cada linha corresponde a uma representação irredutível (denotada por um rótulo de simetria), cada coluna a uma operação de simetria (denotada por sua notação Schoenflies), e as duas últimas colunas indicam quais são os vetores usuais, em particular os orbitais atômicos , que seguem as transformações indicadas por cada representação irredutível.
Com efeito, se todas as operações de simetria do grupo ao qual a molécula está ligada deixam esta última inalterada, uma operação do grupo não deixa necessariamente cada um dos vetores considerados inalterados. Os vetores considerados são frequentemente orbitais atômicos ou vetores espaciais cuja variação descreve uma vibração molecular . É por isso que atribuímos a cada um desses orbitais ou a cada um desses vetores um rótulo de simetria que corresponde à "sua" representação irredutível no grupo da molécula, ou seja, à representação irredutível do grupo que descreve as transformações do considerado vetor. Assim, dizer que dois orbitais moleculares são "da mesma simetria" significa que eles têm a mesma representação irredutível. Este vocabulário é usado em particular em espectroscopia onde as transições entre dois níveis de energia serão consideradas como "permitidas de simetria" se ocorrerem entre dois orbitais da mesma simetria, no sentido aqui indicado.
Operações de simetria e elementos de simetria
Existem cinco famílias de operações de simetria que podem deixar a geometria de uma molécula inalterada: reflexos, inversões, rotações, rotações impróprias e o elemento neutro. Cada operação de simetria está associada a um elemento de simetria, como um eixo, plano ou centro: por exemplo, uma rotação é feita em torno de um eixo de simetria e uma reflexão é feita em relação a um plano de simetria.
Rotações
Se a rotação de uma molécula em torno de um determinado eixo torna uma molécula idêntica à molécula inicial, o eixo em questão é considerado um eixo de rotação de ordem n, designado pelo símbolo C n . Por exemplo, com trifluoreto de boro (BF 3 ), o eixo perpendicular ao plano molecular é um eixo C 3 . Este eixo gera três operações de rotação: C 3 , C 3 2 e C 3 3 = E (o elemento neutro, ver abaixo).
Se uma molécula tem mais de um eixo de rotação, o eixo de maior ordem é denominado eixo principal . Com o trifluoreto de boro, o eixo C 3 é o principal eixo de rotação. Existem também três equivalentes C 2 eixos , um em cada B - F ligação, porque rotativo 180⁰ em torno de uma ligação que passa através de um F única troca o outro dois F.
Em uma molécula linear como HCl ou HC≡CH, o eixo molecular é um eixo de ordem infinita C ∞ , porque existe um número infinito de ângulos de rotação que tornam as moléculas idênticas à molécula inicial.
Reflexões
A reflexão de uma molécula em um plano é chamada de operação de simetria quando gera uma cópia semelhante da molécula inicial. Nesse caso, o plano de reflexão é o elemento de simetria denominado plano de simetria ou plano do espelho , e designado pelo símbolo σ (sigma = s grego, da palavra alemã Spiegel = espelho).
A molécula de formaldeído (H 2 CO) tem dois chamados planos espelhados verticais (símbolo v) porque eles contêm o eixo de rotação (C 2 ) da molécula. O plano designado σ v passa entre os dois hidrogênios, e a reflexão neste plano troca os dois hidrogênios um pelo outro. O plano designado σ v 'contém os dois hidrogênios, que não são então deslocados pela reflexão neste plano. Se uma molécula contém mais de um eixo de rotação, o denominado plano vertical contém o eixo principal.
Em outras moléculas, existe um plano horizontal (σ h ) perpendicular ao eixo principal. No BF 3, por exemplo, o plano da molécula é σ h porque é perpendicular ao eixo C 3 .
A inversão
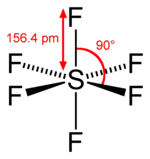
Uma molécula tem um centro de inversão (abreviado como i ) ou centro de simetria se, para cada átomo da molécula fora do centro, houver outro átomo idêntico diretamente no centro e a uma distância igual do centro. De fato, se o centro de simetria está na origem das coordenadas, os átomos idênticos são encontrados nos pontos (x, y, z) e (−x, −y, −z). A operação de inversão envolve mover cada átomo para o átomo idêntico no outro lado do centro.
Pode haver ou não um átomo bem no centro. Por exemplo, hexafluoreto de enxofre (SF 6 ) é octaédrico e seu centro de inversão está no átomo de enxofre, enquanto o benzeno (C 6 H 6 ) é hexagonal no plano e seu centro de inversão está no centro do anel onde nenhum átomo é encontrado .
Rotações impróprias
Em algumas moléculas, a combinação (chamada de produto) de uma rotação C n e a reflexão em um plano perpendicular a este eixo pode ser uma operação de simetria, mesmo que a rotação sozinha ou a reflexão sozinha não sejam operações de simetria. Neste caso, a operação de simetria é denominada rotação-reflexão ou então rotação imprópria (símbolo S n ).
Por exemplo, a ligação CC no etano não é o eixo de simetria C 6 (embora seja o eixo C 3 ), e o plano perpendicular σ h a esta ligação em seu centro também não é o plano de simetria. No entanto, o produto S 6 = σ h C 6 (ou então C 6 σ h ) é de fato uma operação de simetria, porque traz cada átomo em um átomo equivalente. O eixo S 6 gera as operações S 6 , S 6 2 = C 3 , S 6 3 = S 2 = i, S 6 4 = C 3 2 , S 6 5 e S 6 6 = E.
Um eixo S 1 corresponde a um plano de reflexão (sem rotação) e um eixo S 2 corresponde a um centro de inversão. Uma molécula tetraédrica como o metano tem três eixos S 4 .
O elemento neutro
O elemento neutro (ou elemento de identidade) do grupo é abreviado como E, da palavra alemã 'Einheit' que significa unidade. Cada molécula tem esse elemento, que não altera a molécula. Embora esse elemento pareça trivial, ele deve ser incluído no conjunto de elementos de simetria para que seja um grupo matemático , cuja definição requer a inclusão do elemento identidade. Na verdade, é análogo à operação matemática de multiplicação por um, o que não muda o número sobre o qual atua.
Grupos de simetria
Grupos em matemática
As operações de simetria de uma molécula (ou outro objeto) formam um grupo . Em matemática, um grupo é um conjunto com uma operação binária que satisfaz as quatro propriedades de grupo abaixo.
Em um grupo de simetria , os elementos do grupo são as operações de simetria (não os elementos de simetria) e a combinação binária (ou produto) de dois elementos envolve primeiro a aplicação de uma operação de simetria e depois a outra. Por exemplo, a sequência de uma rotação C 4 em torno do eixo z seguida e a reflexão no plano xy é designada σ (xy) C 4 . Por convenção, a ordem das operações é da direita para a esquerda.
Um grupo de simetria obedece às propriedades que definem qualquer grupo:
(1) Encerramento propriedade : Para cada par de elementos de x e y no grupo G , o produto xy também está no mesmo grupo. Isso implica que o grupo é fechado de forma que a combinação de dois elementos não produza nenhum novo elemento. Todas as operações de simetria têm essa propriedade porque a sequência de duas operações deve produzir um terceiro estado indistinguível do segundo estado e, em seguida, também do primeiro estado, de modo que o efeito líquido na molécula é sempre uma operação de simetria.
(2) associativa : Para cada x e y e z no grupo L , os dois combinações triplas ( x y ) z e x ( y z ) dão o mesmo elemento em L . Ou seja, ( x y ) z = x ( y z ) para todos os x , y , e z ∈ L .
(3) Existência de um elemento neutro . Qualquer grupo G deve ter um elemento neutro (ou elemento de identidade) E para que os produtos de E com qualquer elemento x de G deixem o elemento inalterado: xE = Ex = x. Para um grupo de simetria molecular, o elemento neutro é deixar qualquer átomo na posição inalterada.
(4) Existência de um inverso de cada elemento. Para cada elemento de x em L , existe um elemento inversa y tais que xy = yx = E . Por exemplo, o reverso de uma rotação em uma determinada direção é uma rotação no mesmo ângulo, mas na outra direção.
A ordem de um grupo é o número de elementos no grupo.
Grupos de pontos de simetria
A aplicação consecutiva (chamada de composição de duas ou mais operações de simetria de uma molécula corresponde a uma única operação de simetria. Por exemplo, uma rotação C 2 seguida por uma reflexão σ v é equivalente à reflexão σ v '. Isso é escrito σ v * C 2 = σ v ', onde por convenção se escreve à direita a operação que se realiza primeiro O conjunto de todas as operações de simetria da molécula (incluindo as composições) obedece a todas as propriedades de um grupo.
Este grupo é chamado de grupo de simetria de ponto da molécula. A palavra pontual implica que o conjunto de operações de simetria deixa pelo menos um ponto fixo no espaço. (Para algumas operações, um eixo ou plano inteiro permanece fixo.) O grupo de pontos inclui todas as operações que deixam aquele ponto fixo. Por outro lado, a simetria de um cristal é descrita por um grupo espacial que também inclui operações de translação no espaço.
Exemplos de grupos de simetria de ponto
Atribuir um grupo de pontos a cada molécula classifica as moléculas em categorias com propriedades de simetria semelhantes. Por exemplo, PCl 3 , POF 3 , XeO 3 e NH 3 compartilham o mesmo conjunto de seis operações de simetria. Todos eles podem sofrer o elemento neutro E, duas rotações diferentes C 3 e três reflexões diferentes σ v sem alterar suas geometrias, de modo que todos têm o mesmo grupo de pontos de ordem 6 chamado C 3v .
Da mesma forma, água (H 2 O) e sulfureto de hidrogênio (H 2 S) também compartilham operações idênticas de simetria. Ambos sofrem o elemento neutro E, uma rotação C 2 e duas reflexões σ v e σ v '. Este conjunto corresponde ao grupo de pontos C2v de ordem 4.
O fluxograma ao lado nos permite identificar o grupo de pontos de simetria da grande maioria das moléculas. Esse sistema de classificação ajuda os cientistas a estudar as moléculas com mais eficiência, porque as moléculas de natureza química semelhante e do mesmo grupo de simetria geralmente têm conjuntos de ligações e propriedades espectroscópicas semelhantes.
Tabela de grupos de pontos
Esta tabela fornece uma lista de grupos de pontos comuns nomeados de acordo com a notação Schoenflies usada em química e espectroscopia molecular. As estruturas mostradas incluem as formas comuns de moléculas, que muitas vezes podem ser explicadas pela teoria VSEPR .
| Grupo de pontos | Operações de simetria | Descrição simples da geometria típica | Exemplo 1 | Exemplo 2 | Exemplo 3 |
| C 1 | E | sem simetria quiral |
 bromoclorofluorometano (dois enantiômeros indicados) |
 Ácido lisérgico |
 L-leucina e a maioria dos outros α-aminoácidos, exceto glicina |
| C s | E σ h | plano de espelho, nenhuma outra simetria |
 cloreto de tionila , SOCl 2 |
 Ácido Hipocloroso |
 cloroiodometano |
| C i | E eu | centro de inversão |
 Ácido mesotartárico |
( S , R ) 1,2-dibromo-1,2-dicloroetano ( anti- conformador ) | |
| C ∞v | E 2C ∞ Φ ∞σ v | linear |
 fluoreto de hidrogênio (e qualquer outra molécula diatômica heteronuclear) |
 óxido nitroso |
 Cianeto de hidrogenio |
| D ∞h | E 2C ∞ Φ ∞σ i i 2S ∞ Φ ∞C 2 | linear com centro de inversão |
 dioxigênio (e qualquer outra molécula diatômica homonuclear) |
 dióxido de carbono |
 acetileno (etino) |
| C 2 | EC 2 | "geometria do livro aberto", quiral |
 peróxido de hidrogênio |
 hidrazina |
 tetrahidrofurano (conformação torcida) |
| C 3 | EC 3 | hélice de ar , quiral |
 trifenilfosfina |
 trietilamina |
 Ácido fosfórico |
| C 2h | EC 2 i σ h | plano com centro de inversão, sem plano vertical |
 trans - 1,2-dicloroeteno |
 trans - difluoreto de dinitrogênio |
 trans - azobenzeno |
| C 3h | EC 3 C 3 2 σ h S 3 S 3 5 | hélice aérea |
 ácido bórico |
 floroglucinol (1,3,5-trihidroxibenzeno) |
|
| C 2v | EC 2 σ v (xz) σ v '(yz) | angular (angular) (H 2 O) ou gangorra (SF 4 ) ou em forma de T (ClF 3 ) |
 agua |
 tetrafluoreto de enxofre |
 trifluoreto de cloro |
| C 3v | E 2C 3 3σ v | pirâmide trigonal |
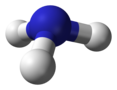 amônia |
 Tricloreto de fosforil , POCl 3 |
 Hidrocarbonil de cobalto , HCo (CO) 4 |
| C 4v | E 2C 4 C 2 2σ v 2σ d | piramidal com base quadrada |
 oxitetrafluoreto de xenônio |
 pentaborano (9) , B 5 H 9 |
 ânion nitroprussiato [Fe (CN) 5 (NO)] 2− |
| C 5v | E 2C 5 2C 5 2 5σ v | Banqueta |
 Ni (C 5 H 5 ) (NO) |
 coranuleno |
|
| D 2 | EC 2 (x) C 2 (y) C 2 (z) | quiral torcido |
 bifenil ( conformador esquerdo ) |
 twistane (C 10 H 16 ) |
Ciclohexano: conformador de barco torcido |
| D 3 | EC 3 (z) 3C 2 | hélice tripla, quiral |
 cátion tris (etilenodiamina) cobalto (III) |
 ânion tris (oxalato) de ferro (III) |
|
| D 2h | EC 2 (z) C 2 (y) C 2 (x) i σ (xy) σ (xz) σ (yz) | plano com centro de inversão e planos verticais |
 etileno |
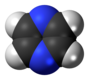 pirazina |
 diborano |
| D 3h | E 2C 3 3C 2 σ h 2S 3 3σ v | plano trigonal |
 trifluoreto de boro |
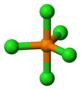 pentacloreto de fósforo |
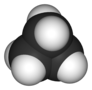 ciclopropano |
| D 4h | E 2C 4 C 2 2C 2 '2C 2 " i 2S 4 σ h 2σ v 2σ d | plano quadrado |
 tetrafluoreto de xenônio |
 ânion octaclorodimolibdato (II) |
 Trans - [Co III (NH 3 ) 4 Cl 2 ] + (átomos de H excluídos) |
| D 5h | E 2C 5 2C 5 2 5C 2 σ h 2S 5 2S 5 3 5σ v | pentagonal |
 ânion ciclopentadienil |
 Rutenoceno |
 C 70 |
| D 6h | E 2C 6 2C 3 C 2 3C 2 '3C 2 ' ' i 2S 3 2S 6 σ h 3σ d 3σ v | hexagonal |
 benzeno |
 bis (benzeno) cromo |
 coroneno (C 24 H 12 ) |
| D 7h | EC 7 S 7 7C 2 σ h 7σ v | heptagonal |
 Íon tropílio (C 7 H 7 + ) |
||
| D 8h | EC 8 C 4 C 2 S 8 i 8C 2 σ h 4σ v 4σ d | octogonal |
 Ânion ciclooctatetraeneto (C 8 H 8 2− ) ânion |
 uranoceno |
|
| D 2d | E 2S 4 C 2 2C 2 '2σ d | torcido 90 ° |
 allene |
 tetranitreto de tetrassulfur |
 diborano (4) (estado excitado) |
| D 3d | E 2C 3 3C 2 i 2S 6 3σ d | torcido 60 ° |
 etano ( conformação escalonada ) |
 dicobalt octacarbonil (isômero sem ponte ) |
 ciclohexano na conformação da cadeira |
| D 4d | E 2S 8 2C 4 2S 8 3 C 2 4C 2 '4σ d | torcido 45 ° |
 ciclooctasulfur (S 8 ) |
 Dimanganês decacarbonil ( rotâmero deslocado) |
 íon octafluoroxenato (geometria ideal) |
| D 5d | E 2C 5 2C 5 2 5C 2 i 2S 10 3 2S 10 5σ d | torcido 36 ° |
 ferroceno (rotâmero deslocado) |
||
| S 4 | E 2S 4 C 2 |
 1,2,3,4-tetrafluorospiropentano |
|||
| T d | E 8C 3 3C 2 6S 4 6σ d | tetraedro |
 metano |
 pentóxido de fósforo |
 adamantano |
| O h | E 8C 3 6C 2 6C 4 3C 2 i 6S 4 8S 6 3σ h 6σ d | octaédrico ou cúbico |
 hexafluoreto de enxofre |
 Hexacarbonil de molibdênio |
 cubano |
| Eu h | E 12C 5 12C 5 2 20C 3 15C 2 i 12S 10 12S 10 3 20S 6 15σ | icosaédrica ou dodecaédrica |
 Buckminsterfullereno (C 60 ) |
 ânion dodecaborado |
 Dodecaedro |
Notas e referências
- Alain Sevin et al., Química Geral - todo o curso em arquivos , Dunod,2012, p. 16-17
- Brian Pfennig , Principles of Inorganic Chemistry , Wiley, 191 p. ( ISBN 978-1-118-85910-0 )
- Brian Pfennig , Principles of Inorganic Chemistry , Wiley ( ISBN 978-1-118-85910-0 )
- Gary Miessler , Química Inorgânica , Pearson,2004( ISBN 9780321811059 , leia online )
- Gary L. Miessler , Química Inorgânica , Prentice-Hall,1999, 2ª ed. , 621-630 p. ( ISBN 0-13-841891-8 )
- Modelo: Housecroft3rd
