Argônio
| Argônio | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Argônio sólido e líquido. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Posição na tabela periódica | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Símbolo | Ar | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Último nome | Argônio | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Número atômico | 18 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo | 18 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Período | 3 e período | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Quadra | Bloco p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Família de elementos | gás nobre | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuração eletronica | [ Ne ] 3 s 2 3 p 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elétrons por nível de energia | 2, 8, 8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades atômicas do elemento | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massa atômica | 39,948 ± 0,001 u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raio atômico (calc) | ( 71 pm ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raio covalente | 106 ± 22h | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raio de Van der Waals | 188 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado de oxidação | 0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Óxido | desconhecido | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energias de ionização | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 re : 15.759610 eV | 2 e : 27.62966 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3 e : 40,74 eV | 4 e : 59,81 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5 e : 75,02 eV | 6 th : 91,009 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 7 e : 124,323 eV | 8 e : 143.460 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 9 e : 422,45 eV | 10 e : 478,69 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 11 e : 538,96 eV | 12 e : 618,26 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 13 e : 686,10 eV | 14 e : 755,74 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 15 e : 854,77 eV | 16 th : 918,03 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 17 e : 4 120,8857 eV | 18 e : 4 426,2296 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isótopos mais estáveis | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades físicas simples do corpo | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado normal | Gás (não magnético) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
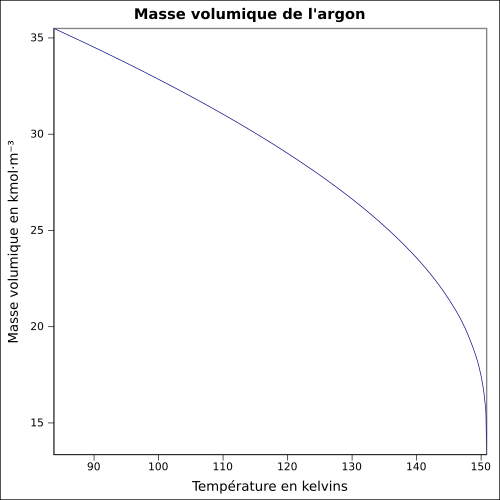
| Massa volumica |
1,7837 g · L -1 ( 0 ° C , 1 atm ) equação:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sistema de cristal | Cúbico centrado no rosto | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cor | incolor | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de fusão | -189,36 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de ebulição | -185,85 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia de fusão | 1.188 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia de vaporização | 6,43 kJ · mol -1 ( 1 atm , -185,85 ° C ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Temperatura critica | -122,3 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto Triplo | −189,3442 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volume molar | 22,414 × 10 -3 m 3 · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pressão de vapor |
equação:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidade do som | 319 m · s -1 a 20 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor maciço |
520 J · kg -1 · K -1
equação:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Condutividade térmica | 0,01772 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vários | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o ECHA | 100.028.315 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o EC | 231-147-0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Precauções | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Aviso H280 e P403 H280 : Contém gás sob pressão; pode explodir se aquecido P403 : Armazenar em local bem ventilado. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| WHMIS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 PARA, A : Temperatura crítica do gás comprimido = −122,4 ° C Divulgação a 1,0% de acordo com os critérios de classificação |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Transporte | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
20 : gás asfixiante ou gás que não apresenta risco subsidiário Número ONU : 1006 : ARGÃO COMPRIMIDO Classe: 2.2 Código de classificação: 1A : Gás comprimido, aspxiante; Etiqueta: 2.2 : Gases não inflamáveis e não tóxicos (corresponde aos grupos designados por A ou O maiúsculo); 
22 : gás liquefeito refrigerado, asfixiante Número ONU : 1951 : ARGONO LÍQUIDO REFRIGERADO Classe: 2.2 Código de classificação: 3A : Gás liquefeito refrigerado, asfixiante; Etiqueta: 2.2 : Gases não inflamáveis e não tóxicos (corresponde aos grupos designados por A ou O maiúsculo);  |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unidades de SI e STP, salvo indicação em contrário. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
O Argônio é o elemento químico de número atômico 18 e símbolo Ar. Pertence ao grupo 18 da tabela periódica e faz parte da família dos gases nobres , também chamados de "gases nobres", que também inclui o hélio , o néon , criptônio , xenônio e radônio . Árgon é o 3 rd mais abundante constituinte da atmosfera da Terra , com uma fracção de massa de 1,288%, o que corresponde a uma fracção de volume de 0,934% (ou 9.340 ppm ), e é o gás nobre mais abundante no mundo. ' Crosta terrestre , representando 1,5 ppm . O argônio na atmosfera terrestre é quase inteiramente composto de argônio 40 , um nuclídeo radiogênico resultante da decomposição do potássio 40 , enquanto o argônio observado no universo é composto principalmente de argônio 36 , produzido pela nucleossíntese estelar nas supernovas .
O nome argônio vem do grego antigo ἀργόν, que significa "ocioso", "preguiçoso" [derivado da palavra grega ἀεργός, formado de ἀ-εργός, que significa "sem trabalho", "ocioso"], com referência ao fato de elemento é quimicamente inerte. Sua configuração eletrônica apresenta uma camada de valência saturada na origem de sua estabilidade e a virtual impossibilidade de estabelecer ligações covalentes . A temperatura de 83,805 8 K de seu ponto triplo é um dos pontos de referência da Escala Internacional de Temperatura de 1990 (ITS-90).
O argônio é produzido industrialmente por destilação fracionada de ar liquefeito . É usado principalmente como uma atmosfera inerte para soldagem e vários processos industriais em alta temperatura envolvendo substâncias reativas. Uma atmosfera de argônio é então usada em fornos elétricos a arco de grafite para evitar a combustão do último. Também emprega argônio na iluminação por lâmpadas incandescentes , lâmpadas fluorescentes e tubos a gás . É usado para produzir lasers de gás azul esverdeado.
Propriedades principais
O argônio é incolor, inodoro, não inflamável e não tóxico em estado gasoso, líquido ou sólido. Sua solubilidade em água é aproximadamente comparável à do oxigênio e 2,5 vezes a do nitrogênio . É quimicamente inerte em quase todas as condições e não forma nenhum produto químico confirmado à temperatura ambiente .
O argônio, entretanto, é capaz de formar compostos químicos sob certas condições extremas de desequilíbrio. O flúor arf de argônio foi assim obtido por fotólise ultravioleta de fluoreto de hidrogênio HF em uma matriz criogênica de iodeto de césio CsI e Ar argônio; estável abaixo de 27 K ( −246,15 ° C ), foi identificado por espectroscopia de infravermelho . O fluorohidreto de argônio é o único composto conhecido de argônio que é neutro e estável no estado fundamental .
O argônio também pode formar clatratos na água quando seus átomos ficam presos na rede tridimensional formada pelo gelo . Existem também íons poliatômicos contendo argônio, como o cátion hidreto de argônio ArH + , e exciplexes , como Ar 2* e ArF *. Vários compostos com ligações Ar C e Ar Se estáveis foram previstos por simulação numérica, mas não foram sintetizados em laboratório.
Os principais isótopos do argônio presentes na crosta terrestre são o argônio 40 ( 40 Ar) a 99,6%, o argônio 36 ( 36 Ar) a 0,34% e o argônio 38 ( 38 Ar) a 0,06%. O potássio-40 ( 40 K) se desintegra espontaneamente a uma taxa de 11,2% em argônio 40 por captura de elétrons ou tomografia de emissão e em uma quantidade de 88,8% em cálcio 40 ( 40 Ca) por desintegração β - com meia-vida (meia -vida) de 1,25 bilhão de anos. Essa duração e a relação entre os subprodutos formados permitem determinar a idade das rochas pelo método de datação potássio-argônio .
Na atmosfera terrestre , o argônio 39 é produzido principalmente pela interação da radiação cósmica no argônio 40 por captura de nêutrons seguida por uma emissão dupla de nêutrons . No subsolo, também pode ser produzido a partir do potássio 39 por captura de nêutrons seguida pela emissão de prótons .
O argônio 37 é produzido durante testes subterrâneos de cálcio 40 por captura de nêutrons seguida por desintegração α ; tem meia-vida de 35 dias.
O argônio é notável porque sua composição isotópica varia significativamente de uma região do Sistema Solar para outra. O argônio, cuja principal fonte é a decomposição radioativa do potássio 40 nas rochas, consiste principalmente em argônio 40 , como nos planetas terrestres que retêm uma atmosfera: Vênus , Terra e Marte . Por outro lado, o argônio formado diretamente pela nucleossíntese estelar é constituído essencialmente pelo argônio 36 produzido pela reação alfa , que é o caso do Sol , cujo argônio é 84,6% do argônio 36 segundo as medidas do vento solar . É o mesmo em planetas gigantes , onde a abundância relativa de isótopos 36 Ar: 38 Ar: 40 Ar é 8400: 1600: 1.
Além da atmosfera terrestre , que tem uma fração volumétrica de argônio de 0,934%, ou 9.340 ppm , a atmosfera de Mercúrio contém 0,07 ppm , a de Vênus contém 70 ppm e a de Marte contém 19,300 ppm , ou 1,93%.
O predomínio do argônio radiogênico 40 na atmosfera terrestre é responsável pelo fato de a massa atômica do argônio terrestre, da ordem de 39,95 u , ser 0,85 u maior que a do potássio , que o segue na tabela periódica dos elementos e cuja massa atômica é da ordem de 39,10 u . Isso parecia paradoxal durante a descoberta do argônio em 1894 porque Dmitri Mendeleïev havia organizado sua tabela periódica em ordem crescente de massa atômica, o que levou a ter que colocar o argônio entre o potássio e o cálcio , com uma massa atômica em torno de 40, 08 u e confundida com a do argônio dentro de 0,13 u , enquanto havia uma diferença de massa atômica de 3,65 u entre o cloro (35,45 u ) e o potássio (39,10 u ). Esse problema foi resolvido por Henry Moseley , que demonstrou em 1913 que a tabela periódica deveria ser organizada em ordem crescente do número atômico , e não pelo aumento da massa atômica, o que colocava os elementos na ordem correta.
A abundância atmosférica de argônio em comparação com outros gases nobres - 9340 ppm de argônio, contra 5,24 ppm de hélio , 18,18 ppm de néon , 1,14 ppm de criptônio e 0,087 ppm de xenônio - também pode ser atribuída ao argônio radiogênico 40 : o argônio 36 realmente tem abundância de apenas 31,5 ppm (0,337% de 9340 ppm ), da mesma ordem de grandeza do neon (18,18 ppm ).
Compostos
O árgon átomo tem um electrão saturada de valência concha , com completas s e p subcamadas . Isso torna este elemento quimicamente inerte e muito estável, ou seja, ele forma uma ligação química com outros átomos apenas com grande dificuldade. Até 1962 , os gases nobres eram considerados totalmente inertes e inadequados para a formação de compostos químicos ; nesta data, no entanto, a síntese de hexafluoroplatinato de xenônio XePtF 6 pavimentou o caminho para a química dos gases nobres .
O primeiro composto de argônio com pentacarbonil de tungstênio, de fórmula química W (CO) 5 Ar, foi publicado em 1975, mas sua existência real permanece controversa. Em agosto de 1962 foi sintetizado na Universidade de Helsinque o fluorohidreto de argônio Harf por fotólise ultravioleta de fluoreto de hidrogênio HF em uma matriz criogênica de iodeto de césio CsI e composto estável de argônio de Ar abaixo de 27 K ( −246,15 ° C ) identificado por espectroscopia de infravermelho . Esta descoberta levou à ideia de que o argônio poderia formar compostos fracamente ligados.
O dicação metaestável ARCf 22+ , isoeletrônico com fluoreto de carbonil COF 2e fosgênio COCl 2do ponto de vista dos elétrons de valência , foi observada em 2009, implementando uma ligação carbono- argônio. O íon molecular 36 ArH + , correspondente ao cátion 36 do hidreto de argônio (argônio), foi detectado no meio interestelar ao nível da Nebulosa do Caranguejo ; é o primeiro composto de gás nobre detectado no espaço .
O hidreto de argônio sólido Ar (H 2 ) 2é um composto de van der Waals com a mesma estrutura cristalina que a fase Laves (en) MgZn 2. Forma-se a pressões entre 4,3 e 220 GPa , embora os resultados obtidos por espectroscopia Raman sugiram que as moléculas de H 2do composto Ar (H 2 ) 2dissociar acima de 175 GPa .
Produção industrial e aplicações
O argônio é produzido industrialmente por destilação fracionada do ar liquefeito em unidades criogênicas de destilação do ar (in) , método de separação do nitrogênio líquido , que ferve a 77,3 K , o argônio, que ferve a 87,3 K , e o oxigênio líquido , que ferve a 90,2 K . A produção mundial de argônio é da ordem de 700.000 toneladas por ano.
O argônio possui várias propriedades interessantes que justificam seu uso industrial:
- é um gás quimicamente inerte;
- é uma alternativa barata quando o nitrogênio não é suficientemente inerte;
- tem baixa condutividade térmica (é, portanto, um isolante térmico );
- suas propriedades eletrônicas ( ionização , espectro de emissão ) são usadas em certas aplicações de iluminação.
Outros gases nobres exibem propriedades semelhantes e também podem ser usados, mas o argônio é de longe o mais barato de todos, sendo obtido como subproduto da extração de oxigênio e nitrogênio do ar por destilação fracionada criogênica.
Aplicações industriais
O argônio é usado em certos processos industriais de alta temperatura nos quais substâncias quimicamente inertes tendem a se tornar reativas. Uma atmosfera de árgon é assim utilizado em fornos eléctricos com grafite eléctrodos em ordem para evitar a combustão deste material.
Para alguns desses processos, a presença de nitrogênio ou oxigênio causaria defeitos no material. O argônio é usado em certos tipos de soldagem a arco , como soldagem a arco de metal a gás e soldagem TIG , bem como no tratamento de titânio e outros elementos reagentes. Cristais de silício e germânio destinados à indústria de semicondutores também são cultivados em atmosfera de argônio para garantir sua qualidade cristalina.
Árgon é usado na indústria de aves de capoeira como um método de asfixia com gás inerte para asfixiar o aves domésticas , quer para um abate de massa após o início de uma doença ou como um meio de abate alternada a electronarcosis . A densidade relativa do argônio ao ar faz com que ele fique próximo ao solo durante a gaseificação. Sua natureza não reativa o torna compatível com produtos alimentícios, e o fato de substituir parcialmente o oxigênio nos tecidos prolonga a vida útil dos alimentos.
Às vezes, o argônio é usado para extinguir incêndios, preservando equipamentos valiosos, como servidores de computador , que seriam danificados pelo uso de água ou espuma.
Aplicações médicas
Os procedimentos de criocirurgia (in) , como a crioablação (in), usam argônio líquido para destruir tecidos como as células cancerosas . Tem sido possível utilizá-lo em um procedimento denominado coagulação com argônio , que é uma forma de eletrocirurgia (in) por tocha de plasma , mas que apresenta risco de embolia gasosa materializada pela morte de pelo menos um paciente.
Os lasers de argônio azul são usados em cirurgias para suturar as artérias , destruir tumores em cirurgias oculares ou para eletrocoagulação através de lesões endoscópicas e sangramento gastrointestinal.
Árgon também foi testado para substituir azoto no gás respiratório chamado Argox em fim de acelerar a remoção de azoto dissolvido a partir do sangue .
Pesquisa científica
O argônio líquido é usado como alvo para detecção de neutrinos e pesquisa de matéria escura . As interações entre WIMPs hipotéticos e os núcleos dos átomos de argônio devem produzir uma cintilação observável através de tubos fotomultiplicadores . Detectores bifásicos contendo gás argônio são usados para detectar elétrons produzidos por ionização durante as interações WIMP-núcleo de argônio.
Como outros gases nobres liquefeitos, o argônio líquido tem uma alta taxa de cintilação (aproximadamente 51 fótons / keV ), é transparente para sua própria cintilação e é relativamente fácil de purificar. É mais barato que o xenônio e possui um perfil de tempo de cintilação diferente, o que permite distinguir as interações eletrônicas das nucleares. Tem no entanto uma forte β radioactividade devido a contaminação pela atmosfera de árgon 39 , excepto o uso de árgon a partir da cave Terra empobrecido em 39 Ar cuja meia vida é de apenas 269 anos e cujo estoque não é reconstituída pela 40 Ar ( n , 2 N ) 39 Interação Ar da radiação cósmica no argônio atmosférico .
Em outro registro, o argônio 39 foi usado em particular para datar amostras de água subterrânea e gelo na Antártica . A datação K-Ar e a datação argônio-argônio também são usadas para a datação radiométrica de sedimentos , metamórficos e ígneos .
Conservador
Argônio, número E938 , é usado como conservante de alimentos para remover oxigênio e umidade da atmosfera na embalagem e para atrasar sua data de validade. A oxidação pelo ar, a hidrólise e outras reações que degradam o produto são retardadas ou completamente bloqueadas. Reagentes químicos e moléculas farmacêuticas às vezes são embalados em uma atmosfera de argônio. Este gás nobre também é usado como conservante para vernizes , poliuretano ou mesmo tintas .
O argônio também é usado na vinificação para proteger o vinho do oxigênio e prevenir sua oxidação, bem como interações bacterianas indesejadas (especialmente bactérias acéticas , que produzem ácido acético e transformam o vinho em vinagre ). Também pode ser usado como propelente para sprays .
Equipamentos de laboratório
O argônio pode ser usado como gás inerte para uma linha de vácuo e porta-luvas ; é preferível ao nitrogênio , que é mais barato, porque o nitrogênio é capaz de reagir com compostos particularmente reativos, bem como com certos equipamentos. Além disso, o argônio tem a vantagem de ser mais denso que o ar, ao contrário do nitrogênio, o que o torna mais fácil de usar na prática.
O argônio pode ser usado como gás de arraste em cromatografia gasosa e na ionização por eletrospray . É o gás de escolha para plasma usado em espectrometria de plasma acoplado indutivamente . O argônio é preferencialmente usado na deposição por pulverização catódica (In) nas amostras a serem examinadas por Microscopia Eletrônica de Varredura e para limpar wafers na microfabricação .
Iluminação
Uma lâmpada incandescente geralmente é preenchida com argônio para preservar seu filamento da oxidação em alta temperatura. O argônio também é usado para sua radiação por ionização , como nas lâmpadas de plasma e nos calorímetros na física de partículas . As lâmpadas de descarga cheias de argônio puro produzem violeta pálido claro puxando alfazema lebleu, que se torna azul com a adição de um pouco de mercúrio .
O argônio também é usado para lasers de íon (in) azul e verde.
Vários aplicativos
O argônio é usado como isolante térmico para vidros duplos . Também é usado para encher roupas secas para mergulho, devido à sua inércia química e baixa condutividade térmica .
O argônio é um dos gases que podem ser usados na astronáutica como propelente de VASIMRs . No campo do armamento aéreo , é usado sob pressão para resfriar, por meio do relaxamento, as cabeças de certos mísseis ar-ar , incluindo os mísseis AIM-9 Sidewinder .
O argônio tem sido usado no atletismo como um dopante que simula a hipóxia . Por isso, foi incluído, juntamente com o xenônio , na lista de métodos e substâncias proibidos pela Agência Mundial Antidopagem em 2014, antes de ser retirado em 2020.
História e etimologia
A palavra argônio deriva do grego antigo ἀργός / argós ("ocioso", "preguiçoso", "estéril"), formado pelo prefixo grego privado ἀ e pela palavra ἔργον / ergon ("trabalho"), esta etimologia evocando o caráter inerte do elemento '.
A presença no ar de um gás quimicamente inerte foi suspeitada por Henry Cavendish já em 1785, mas sua descoberta por Lord Rayleigh e Sir William Ramsay na University College London esperou até 1894 . Eles fizeram isso removendo oxigênio , dióxido de carbono , vapor de água e nitrogênio de uma amostra de ar limpo , deixando um gás inerte que eles chamaram de argônio . Esses dois cientistas fizeram a comunicação oficial de sua descoberta à Royal Society em31 de janeiro de 1895.
Eles foram prejudicados pelo fato de o nitrogênio produzido quimicamente ser 0,5% mais leve do que o extraído do ar pela remoção de outros gases atmosféricos conhecidos na época. A destilação fracionada do ar liquefeito permitiu-lhes produzir uma quantidade significativa de argônio em 1898 e ao mesmo tempo isolar dois outros gases nobres, o néon e o xenônio .
O argônio também foi observado em 1882 durante um trabalho independente de HF Newall e WN Hartley, que notou linhas espectrais no espectro de emissão do ar que não correspondiam a nenhum elemento químico conhecido.
O símbolo químico do argônio era A até 1957, quando se tornou Ar.
Perigos
Como o hélio , o argônio não é perigoso em baixas concentrações. No entanto, é 38% mais denso que o ar , e inalar uma grande quantidade de argônio acarreta o risco de asfixia pela privação de oxigênio ( anoxia ); isso pode ocorrer, por exemplo, durante as operações de soldagem em um espaço confinado.
Notas e referências
- (in) Beatriz Cordero Verónica Gómez, Ana E. Platero-Prats, Marc Revés Jorge Echeverría, Eduard Cremades, Flavia e Santiago Barragan Alvarez , " Rádios covalentes revisitados " , Dalton Transactions ,2008, p. 2832 - 2838 ( DOI 10.1039 / b801115j )
- (em) David R. Lide, CRC Handbook of Chemistry and Physics , TF-CRC,2006, 87 th ed. ( ISBN 0849304873 ) , p. 10-202
- (en) David R. Lide, CRC Handbook of Chemistry and Physics , CRC Press Inc,2009, 90 th ed. , 2804 p. , Capa dura ( ISBN 978-1-420-09084-0 )
- (en) Robert H. Perry e Donald W. Green , Perry's Chemical Engineers 'Handbook , EUA, McGraw-Hill,1997, 7 th ed. , 2400 p. ( ISBN 0-07-049841-5 ) , p. 2-50
- Atas do Comitê Internacional de Pesos e Medidas , 78 a Sessão, 1989, pp. T1-T21 (e pp. T23-T42, versão em inglês).
- Banco de dados do Chemical Abstracts consultado via SciFinder Web 15 de dezembro de 2009 ( resultados da pesquisa )
- Entrada de número CAS "7440-37-1" no banco de dados química GESTIS da IFA (organismo alemão responsável pela segurança e saúde ocupacional) ( alemão , Inglês ), acessado em 30 de janeiro de 2009 (JavaScript obrigatório)
- " Argon " no banco de dados de produtos químicos Reptox da CSST (Organização de Quebec responsável pela segurança e saúde ocupacional), acessado em 25 de abril de 2009
- (em) Markku Räsänen , " Argon out of thin air " , Nature Chemistry , vol. 6, n o 1, Janeiro de 2014, Artigo n o 82 ( PMID 24345939 , DOI 10.1038 / nchem.1825 , lido online )
- (en) Leonid Khriachtchev, Mika Pettersson, Nino Runeberg, Jan Lundell e Markku Räsänen , “ Um composto de argônio estável ” , Nature , vol. 406, n o 6798, 24 de agosto de 2000, p. 874-876 ( PMID 10972285 , DOI 10.1038 / 35022551 , Bibcode 2000Natur.406..874K , ler online )
- (em) VR Belosludov OS Subbotin DS Krupskii, Prokuda OV, RV e Y. Belosludov Kawazoe , " Microscopic model of clathrate components " , Journal of Physics: Conference Series , Vol. 29, n o 1, janeiro de 2006, p. 1-7 ( DOI 10.1088 / 1742-6596 / 29/1/001 , Bibcode 2006JPhCS..29 .... 1B , ler online )
- (em) Arik Cohen, Jan Lundell e R. Benny Gerber , " Primeiros compostos com ligações químicas argônio-argônio e carbono-silício " , Journal of Chemical Physics , vol. 119, n o 13, Outubro de 2003, p. 6415-6417 ( DOI 10.1063 / 1.1613631 , Bibcode 2003JChPh.119.6415C , ler online )
- (en) J. Emsley, Nature's Building Blocks , Oxford University Press, 2001, p. 44–45 . ( ISBN 978-0-19-960563-7 )
- Etienne Roth ( dir. ), Bernard Poty ( dir. ), Robert Delmas et al. ( pref. Jean Coulomb ), Métodos de datação por fenômenos nucleares naturais , Paris, Éditions Masson , col. "Coleção CEA ",1985, 631 p. ( ISBN 978-2-225-80674-2 , aviso BnF n o FRBNF34836710 ) , cap. 17 ("Silício 32 e argônio 39")
- (in) O Caso Científico de 37 Ar como um Monitor para Explosões Nucleares Subterrâneas , página 1, 2010
- (em) Katharina Lodders , " The Solar Abundance Argon " , The Astrophysical Journal , vol. 674, n o 1, 10 de fevereiro de 2008, p. 607-611 ( DOI 10.1086 / 524725 , Bibcode 2008ApJ ... 674..607L , arXiv arXiv: 0710.4523 , ler online )
- (em) AGW Cameron , " Elemental and isotopic abundances of the volatile Elements in the outer planets " , Space Science Reviews , vol. 14, n osso 3-4, Março de 1973, p. 392-400 ( DOI 10,1007 / BF00214750 , bibcode 1973SSRv ... 14..392C , lido online )
- (em) Marco Fontani , Mariagrazia Costa e Mary Virginia Orna , The Lost Elements: The Periodic Table's Shadow Side , Nova York, Oxford University Press ,2015( 1 st ed. 2014), 531 p. ( ISBN 9780199383344 ) , p. 182.
- (em) Neil Bartlett , " Xenon hexafluoroplatinate Xe + [PtF 6 ] - " , Proceedings of the Chemical Society , N o 6,Junho de 1962, p. 197-236 ( DOI 10.1039 / PS9620000197 , leia online )
- (em) Nigel A. Young , " Química de coordenação do grupo principal em baixa temperatura: Uma revisão da matriz isolada do Grupo 12 a complexos do Grupo 18 " , Coordination Chemistry Reviews , vol. 257 n ossos 5-6, Março de 2013, p. 956-1010 ( DOI 10.1016 / j.ccr.2012.10.013 , leia online )
- (em) Neil Bartlett , " The Noble Gases " , Chemical & Engineering News , Vol. 81, n o 36, 8 de setembro de 2003, p. 32-34 ( DOI 10.1021 / cen-v081n036.p032 , leia online )
- (em) Jessica F. Lockyear Kevin Douglas, Stephen D. Price, Małgorzata Karwowska, Karol J. Fijalkowski Wojciech Grochala Marek Remeš Jana Roithová e Detlef Schroeder , " Geração do ARCf 2 2+ Dication ”, The Journal of Physical Chemistry Letters ,vol. 1,n o 1,8 de dezembro de 2009, p. 358-362 ( DOI 10.1021 / jz900274p , leia online )
- (en) J. Barlow, BM Swinyard, PJ Owen, J. Cernicharo, HL Gomez, RJ Ivison, O. Krause, TL Lim, M. Matsuura, S. Miller, G. Olofsson e AND Polehampton , " Detection of a Noble Gas Molecular Ion, 36 ArH + , na Nebulosa do Caranguejo ” , Science , vol. 342, n o 6164, 13 de dezembro de 2013, p. 1343-1345 ( PMID 24337290 , DOI 10.1126 / science.1243582 , Bibcode 2013Sci ... 342.1343B , ler online )
- (em) Annette K. Kleppe, Mónica Amboage e Andrew P. Jephcoat , " Novo composto de van der Waals de alta pressão Kr (H 2) 4 descoberto no sistema binário criptônio-hidrogênio ” , Scientific Reports , vol. 4,16 de maio de 2014, Artigo n o 4989 ( DOI 10.1038 / srep04989 , bibcode 2014NatSR ... 4E4989K , lido online )
- " Tabela Periódica dos Elementos: Argônio - Ar " , Environmentalchemistry.com (acessado em 12 de setembro de 2008 )
- (em) Sara J. Shields e ABM Raj , " A Critical Review of Electrical Water-Bath Stun Systems for Poultry Slaughter and Recent Developments in Alternative Technologies " , Journal of Applied Animal Welfare Science , vol. 13, n o 4, 2012, p. 281-299 ( PMID 20865613 , DOI 10.1080 / 10888705.2010.507119 , ler online )
- DL Fletcher , " Slaughter Technology, " Symposium: Recent Advances in Poultry Slaughter Technology ,1999( Leia on-line , acessado 1 st janeiro 2010 )
- (em) MJ Fraqueza e AS Barreto , " O efeito é a vida útil da carne de peru em embalagens de atmosfera modificada com uma mistura de argônio " , Poultry Science , vol. 88, n o 9, Setembro de 1999, p. 1991-1998 ( PMID 19687286 , DOI 10.3382 / ps.2008-00239 , ler online )
- (em) Joseph Z. Su, Andrew K. Kim, George P. Crampton e Zhigang Liu , " Fire Suppression with Inert Gas Agents " , Journal of Fire Protection Engineering , vol. 11, n o 2 2001, p. 72-87 ( DOI 10.1106 / X21V-YQKU-PMKP-XGTP , leia online )
- (em) " Fatal Gas Embolism Cause by Overpressurization during Laparoscopic Use of Argon Enhanced Coagulation " , Health Devices , vol. 23, n o 6, Junho de 1994, p. 257-259 ( ler online )
- (in) Jerome Canady , Kimberly Wiley e Biagio Ravo , " coagulação de plasma de argônio e as aplicações futuras para sondas endoscópicas Dual-Mode " , Reviews in Gastroenterological Disorders , Vol. 6, n o 1,2006, p. 1-12 ( ISSN 1533-001X , PMID 16520707 , ler online , acessado em 9 de outubro de 2017 ).
- (em) Andrew A Pilmanis Ulf I. Balldin, James T. Webb e Kevin M. Krause , " Staged Decompression to 3.5 Psi Using Argon-Oxygen and Oxygen Breathing 100% Mixtures " , Aviation, Space, and Environmental Medicine , flight. 74, n o 12, dezembro 2003, p. 1243-1250 ( PMID 14692466 , leia online )
- (em) Dan Gastler Ed Kearns, Andrew Hime, Laura C. Stonehill Stan Seibert, Josh Klein, Hugh W. Lippincott, Daniel N. McKinsey e James A. Nikkel , " Measurement of cintillationfficiency for nuclear recoils in liquid argon " , Physical Review C , vol. 85, n o 6, 27 de junho de 2012, Artigo n o 065811 ( DOI 10,1103 / PhysRevC.85.065811 , bibcode 2012PhRvC..85f5811G , arXiv 1004,0373 , lido online )
- (em) J.Xu F. Calaprice, C. Galbiati, A. Goretti Guray G., T. Hohman, D. Holtz, An. Ianni, Sr. Laubenstein, Loer B., C. Lovec, CJ Martov, D .Montanari, S. Mukhopadhyay, A. Nelson, SD Rountree, RB Vogelaar e A. Wright , “ Um estudo do traço 39 Ar conteúdo em argônio de fontes subterrâneas profundas ” , Astroparticle Physics , vol. 66, junho de 2015, p. 53-60 ( DOI 10.1016 / j.astropartphys.2015.01.002 , Bibcode 2015APh .... 66 ... 53X , arXiv 1204.6011 , ler online )
- Paul Depovere, A Tabela Periódica dos Elementos. A maravilha fundamental do Universo , De Boeck Supérieur ,2002, p. 98.
- (en) Henry Cavendish , " XXIII. Experimentos no ar. ” , Philosophical Transactions of the Royal Society of London , vol. 75, 1785, p. 372-384 ( DOI 10.1098 / rstl.1785.0023 , bibcode 1785RSPT ... 75..372C , lido online )
- (em) Robert John Strutt e William Ramsay , " I. Argon, uma nova forma da atmosfera " , Proceedings of the Royal Society of London , vol. 57, 1895, p. 265-287 ( DOI 10.1098 / rspl.1894.0149 , JSTOR 115394 , ler online )
- (em) John William Strutt e William Ramsay , " VI. Argônio, um novo constituinte da atmosfera ” , Philosophical Transactions of the Royal Society of London , 1895, p. 187-241 ( DOI 10.1098 / rsta.1895.0006 , JSTOR 90645 , Bibcode 1895RSPTA.186..187R , ler online )
- (em) Sir William Ramsay, " The Rare Gases of the Atmosphere " , em https://www.nobelprize.org/ , Prêmio Nobel de Química , 12 de dezembro de 1904(acessado em 14 de junho de 2020 ) .
- (em) John H. Holloway, química de gases nobres , Methuen,1968, p. 6
- (em) John Emsley, Nature's Building Blocks: An AZ Guide to the Elements , Oxford University Press, 2003, p. 36 . ( ISBN 0198503407 )
- (em) Norman E. Holden, " História da Origem dos Elementos Químicos e Seus Descobridores ' , 41ª Assembleia Geral da IUPAC em Brisbane, Austrália, 29 de junho a 8 de julho de 2001 , em https: //www.nndc.bnl. gov / , National Nuclear Data Center , 12 de março de 2004(acessado em 14 de junho de 2020 ) .
Veja também
Artigos relacionados
links externos
- (pt) “ Dados técnicos para argônio ” (acessado em 24 de abril de 2016 ) , com os dados conhecidos para cada isótopo em subpáginas
- (In) Imagens de argônio em diferentes formas
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | ei | |||||||||||||||||||||||||||||||
| 2 | Li | Ser | B | VS | NÃO | O | F | Nascer | |||||||||||||||||||||||||
| 3 | N / D | Mg | Al | sim | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Naquela | Sc | Ti | V | Cr | Mn | Fe | Co | Ou | Cu | Zn | Ga | Ge | Ás | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | CD | Em | Sn | Sb | Você | eu | Xe | |||||||||||||||
| 6 | Cs | BA | O | este | Pr | WL | PM | Sm | Teve | D'us | Tb | Dy | Ho | Er | Tm | Yb | Ler | Hf | Sua | C | D | Osso | Ir | Pt | No | Hg | Tl | Pb | Bi | Po | No | Rn | |
| 7 | Fr | Ra | Ac | º | Pa | você | Np | Poderia | Sou | Cm | Bk | Cf | É | Fm | Md | Não | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| 8 | 119 | 120 | * | ||||||||||||||||||||||||||||||
| * | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129 | 130 | 131 | 132 | 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 | 141 | 142 | |||||||||||
|
Metais Alcalinos |
Alcalino- terroso |
Lantanídeos |
Metais de transição |
Metais pobres |
Metal- loids |
Não metais |
genes halo |
Gases nobres |
Itens não classificados |
| Actinides | |||||||||
| Superactinides | |||||||||